
3.noise A.purpose B.course C.choose D.practise
2.umbrella A.pupil B.industry C.button D.butcher
第一节语音知识(共5小题:每小题l分,满分5分)
从A、B、C、D四个选项中,找出其划线部分与所给单词的划线部分读音相同的选项,并在答题卡上将该项涂黑。
例:have A.gave B.save C.hat D.made 答案是C。
1.through A.plough B.cough C.enough D.tough
2.(2)224 mL
(3)24a L≤V≤(2.24a+1.12b) L
14.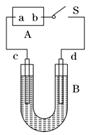 (10分)如图,A为直流电源,B为电解槽,c、d为石墨电极,B
(10分)如图,A为直流电源,B为电解槽,c、d为石墨电极,B
中存放有100 mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的
量浓度0.1 mol/L,闭合S,d极收集到标准状况下气体甲448 mL,
该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下
测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解
和吸收.请回答下列问题.
(1)A电源的a极是________,d极发生反应的电极反应式是_________________________________________________________________.
(2)c极理论上收集到的气体的体积是________(标准状况下).
(3)假设100 mL溶液中,c(Cu2+)=a mol/L,c(Na+)=b mol/L,Cu2+完全放电后,理论上d极产生甲气体的体积V的范围是____________________(用含a、b的代数式表示).
解析:(1)Cl-在d极失去电子生成Cl2:2Cl--2e-===Cl2↑,d极为电解池的阳极,c极为电解池的阴极,a极为电源的负极.
(2)含有Cu2+、Na+、H+、Cl-、OH-的混合液中,根据放电能力,Cl-首先在d极失去电子,n(e-)=0.04 mol,Cu2+在c极获得电子0.02 mol,剩余0.02 mol e-由H+获得,生成0.01 mol H2,即标准状况下的体积为224 mL.
(3)c(Cu2+)=a mol·L-1,当只有CuCl2提供的Cl-在d极放电时得到0.1a mol Cl2.c(Na+)=b mol·L-1,当溶液中所有的Cl-在d极放电时得到(0.1a+0.05b) mol Cl2,故所得Cl2 积V范围为:2.24a L≤V≤(2.24a+1.12b) L.
答案:(1)负极 2Cl--2e-===Cl2↑
13.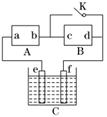 (11分)如图所示,A为直流电源,B为渗透饱和氯化钠溶
(11分)如图所示,A为直流电源,B为渗透饱和氯化钠溶
液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B
上的c点显红色,请填空:
(1)电源A的a为________极.
(2)滤纸B上发生的总反应方程式为:__________________________________________________________________.
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:______________________________,电极f上发生的反应为:________________________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液).
解析:电解饱和氯化钠溶液时发生的电解反应为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,根据“B上的c点显红色”可以判断c电极为阴极(为H+放电),故b为直流电源负极,a为直流电源正极.在电镀槽中实现铁上镀锌,则锌为阳极(e电极),电极反应为:Zn-2e-===Zn2+;铁为阴极(f电极),电极反应为:Zn2++2e-===Zn,电解液为含有Zn2+的可溶性盐溶液.
答案:(1)正
(2)2NaCl+2H2O2NaOH+H2↑+Cl2↑
(3)Zn-2e-===Zn2+ Zn2++2e-===Zn ZnSO4溶液 ZnCl2溶液
12.(12分)铝和氢氧化钾都是重要的工业产品.请回答:
(1)工业冶炼铝的化学方程式是_____________________________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是____________________________.
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.

①该电解槽的阳极反应式是________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因:
________________________________________________________________________
________________________________________________________________________.
③除去杂质后的氢氧化钾溶液从液体出口________(填写“A”或“B”)导出.
解析:(1)、(2)问主要考查教材的基础知识,应该属于得分的问题,(3)中根据电解原理,阳极应是OH-失电子,所以电极反应式为4OH--4e-===2H2O+O2↑,而阴极为H+放电,促进水的电离,使OH-浓度增大,所以pH增大,根据阳离子交换膜的特点,K+可从阳极区进入阴极区和OH-组成KOH,从而可在阴极区得纯的KOH,故液体应从B口导出.
答案:(1)2Al2O34Al+3O2↑
(2)2Al+2OH-+2H2O===2AlO+3H2↑
(3)①4OH--4e-===2H2O+O2↑
②H+放电,促进水的电离,OH-浓度增大,pH升高
③B
4.(2)红 (3)48 L 1.0 mol/L 14
11.(17分)如图为相互串联的甲乙两电解池.
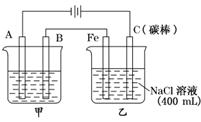
试回答:
(1)甲池若为用电解原理精炼铜的装置,A是________极,材料是________,电极反应为________________________________,B是________极,材料是________,主要电极反应为________________________________,电解质溶液为________.
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe极附近呈________色.
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为
________.若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为
________,pH为________.
解析:(1)甲为粗铜精炼装置,A是阴极,材料为纯铜,电极反应为Cu2++2e-===Cu,B是阳极,材料为粗铜,主要电极反应为Cu-2e-===Cu2+,电解质溶液为CuSO4或CuCl2溶液.
(2)乙池为电解NaCl溶液的装置,其中铁作阴极,H+放电,相当于生成了OH-,使酚酞试液变红色.
(3)若甲池阴极增重12.8 g,即生成了0.2 mol 纯铜,转移了0.4 mol 电子,根据串联电路中转移电子数相等,由乙池中阳极上发生的反应2Cl--2e-===Cl2↑知,产生0.2 mol Cl2,标准状况下的体积为4.48 L;由阴极上的电极反应2H++2e-===H2↑知,溶液中剩余0.4 mol OH-,若乙池中剩余液体为400 mL,则电解后得到OH-的物质的量浓度为1.0 mol/L,pH为14.
答案:(1)阴 纯铜 Cu2++2e-===Cu 阳 粗铜
Cu-2e-===Cu2+ CuSO4(其它合理也可以)
10.(2010·安庆模拟)如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是 ( )
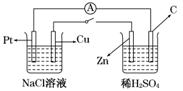
A.Cu极附近OH-浓度增大
B.Cu极为原电池负极
C.电子流向是由C极流向Pt极
D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成
解析:闭合开关后,右侧装置中有自发的氧化还原反应,是原电池,Zn作原电池的负极,C作正极.左侧装置是电解池,Cu作阴极,Pt作阳极,B项错误.Cu电极的电极反应式为2H++2e-===H2↑,OH-浓度增大,A项正确.电子流向应由电解池的阳极Pt流向原电池的正极C,C项错误.Pt电极的电极反应式为2Cl--2e-===Cl2↑,当有4 mol电子转移时,Pt电极上有2 mol Cl2生成.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com