
25. 有可逆反应A(g)+3B(g) 2C(g)+Q(Q>0)
有可逆反应A(g)+3B(g) 2C(g)+Q(Q>0)
(1)写下该反应的平衡常数表达式: ;升高温度,平衡常数K将 (填“增大”,“减小”。“不变”)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20min后又达新平衡。试推测,与原平衡状态相比,第15min时,V正 (填“增大”,“减小”,“不变”),V逆 (填“增大”,“减小”。“不变”)。
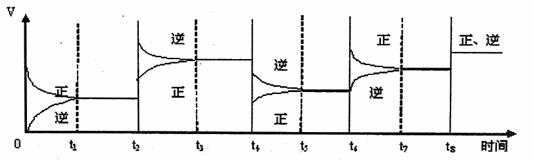 (3)该反应的速率与时间的关系如下图所示:
(3)该反应的速率与时间的关系如下图所示:
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,试判断改变的是什么条件。
t2时 ;t4时 ;t6时 ;t8时 ;
24.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O、HF;
第三周期 SiH4>PH3> > 。
(2)化合物的毒性:PH3>NH3 H2S H2O;
CS2 CO2 CCl4>CF4 (选填>或<)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是 。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。但求助于周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
(a)①②③ (b)②④⑤ (c)②③④
23.KClO3和浓盐酸在一定温度下反应回生成绿黄色的易爆物二氧化氯。其变化可表示为:
___KClO3 +__HCl(浓) → ___KCl +___ClO2↑+___Cl2↑+ ___ _____
(1)请完成该化学方程式并配平(未知物化学式和系数填入横线上方)
(2)浓盐酸在该溶液中显示出来的性质是 (填写编号,多选倒扣)。
① 只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒的效率(以单位质量得到的电子数表示)是Cl2的 倍。
22.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+4、Cl-、Mg2+、Ba2+、CO2-3、SO2-4,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01molCO2-3
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
20.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 ( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.KalO2和H2SO4 D.Ca(HCO3)2和Ba(OH)2
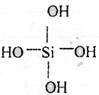 21.两个原硅酸分子的氢氧原子间可以相互作用脱去1分子水:
21.两个原硅酸分子的氢氧原子间可以相互作用脱去1分子水:
2H4SiO4→H6Si2O7+H2O,原硅酸的结构简式为:
则在脱水产物H6Si2O7分子结构中,含硅氧键数目为 ( )
|
 18.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示。下列有关叙述错误的是 ( )
18.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示。下列有关叙述错误的是 ( )
A.分子式为C10H9O3 B.能发生水解反应
C.能使酸性KMnO4溶液褪色 D.1mol香豆素-4最多消耗2mol NaOH
19. 对于反应2SO2+O2 2SO3,下列判断正确的是 ( )
对于反应2SO2+O2 2SO3,下列判断正确的是 ( )
A.2体积SO3和足量O2反应,必定生成2体积SO3
B.其它条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
16.下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HclO4 ④结合质子能力:OH->HCO-3>CH3COO-
A.①③ B.②④ C.①④ D.②③
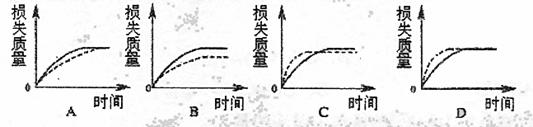 17.将Ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将Bg(A>B)粉末状碳酸钙与同浓度足量盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )
17.将Ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将Bg(A>B)粉末状碳酸钙与同浓度足量盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )
15.欲在有Y存在的情况下,用一种试剂Z来检验盐溶液中的离子X,下表中对应的试Z合理的是 ( )
|
|
A |
B |
C |
D |
|
试剂Z |
氨水 |
硝酸银溶液 |
硫酸钠溶液 |
硝酸钡溶液 |
|
X |
Mg2+ |
Cl- |
Ba2+ |
SO2-4 |
|
Y |
Al3+ |
CO2-3 |
Mg2+ |
SO2-3 |
13.NaH是一种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是( )
A.跟水反应时,水作氧化剂 B.NaH中H-半径比Li+半径小
C.跟液氨反应时,有NaNH2生成 D.跟乙醇反应时,NaH被氧化
|

 14.在密闭容器中发生的下列反应:(I)2A(g)+B(g) 2C(g)+Q(Q>0),(II)3A(g)
14.在密闭容器中发生的下列反应:(I)2A(g)+B(g) 2C(g)+Q(Q>0),(II)3A(g)
D(g)+E(g)+Q(Q<0),达到平衡后,改变下列条件均能使反应(I)、(II)
中A的转化率增大的是 ( )
①缩小容器体积 ②升高温度 ③增加A的浓度
A.仅① B.①③ C.①②③ D.都不能
12.有关晶体的下列说法中正确的是 ( )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com