
6.从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过
A.加成反应 B.取代反应 C.聚合反应 D.催化裂化反应
5.维生素C的结构简式为 有关它的叙述错误的是
A.是一个环状的酯类化合物 B.易起加成及氧化反应
C.可以溶解于水 D.在碱性溶液中能稳定地存在
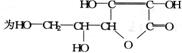
4. 丁腈橡胶
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是 ( )
丁腈橡胶
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是 ( )
①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④CH3-CH =CH ⑤CH3-CH==CH2 ⑥CH3-CH=CH-CH3
│
CN
A.③⑥ B.②③ C.①③ D.④⑤
3.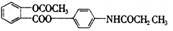 某种解热镇痛药的结构简式为 ( )
某种解热镇痛药的结构简式为 ( )
当它完全水解时,可得到的产物有
 A.2种 B.3种 C.4种
D.5种
A.2种 B.3种 C.4种
D.5种
2.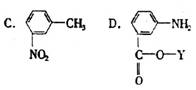 已知-NH2,连在苯环上显碱性,而-NH2连在酰基上(-C-NH2)显中性,下列同分异构体中既显酸性又显碱性的物质是
( )
已知-NH2,连在苯环上显碱性,而-NH2连在酰基上(-C-NH2)显中性,下列同分异构体中既显酸性又显碱性的物质是
( )

1.下列关于蛋白质的叙述中,不正确的是 ( )
A.向蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质
B.在豆浆中加入少量的石膏,能使豆浆凝结为豆腐
C.温度越高,酶对某些化学反应的催化效率越高
D.当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒
|
|
5.沉淀的转化
(1)实验3-4在01.mol/LAgNO3溶液中滴加01.mol/LNaCl溶液,再滴加01.mol/LKI溶液,
又再滴加01.mol/LNa2S溶液,观察
|
步骤 |
NaCl和AgNO3溶液混合 |
向固体混合物中滴加01.mol/LKI溶液 |
向新固体混合物中滴加01.mol/LNa2S溶液 |
|
现象 |
|
|
|
(2)实验3-5向盛有1mL01.mol/LMgCl2溶液中滴1-2滴NaOH溶液,再滴加2滴.mol/LFeCl3溶液,观察
|
步骤 |
向MgCl2溶液中滴1-2滴NaOH溶液 |
向白色沉淀中加2滴.mol/LFeCl3溶液 |
|
现象 |
|
|
(3)对于一些用酸或其他方法也不能溶的沉淀,可先将其转化为另一种用酸或其他方法能溶解的 。
(4)水垢中含CaSO4的处理。先用 溶液处理,再用盐酸除去。

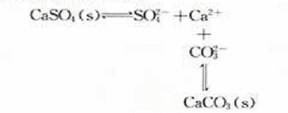
小结:沉淀的溶解的方法
常用的方法是:在难溶电解质饱和溶液中加入适当试剂使之与组成沉淀的一种构晶离子结合成另一类化合物,从而使之溶解。具体办法可采用酸碱溶解法、配位溶解法、氧化还原溶解法以及沉淀转化溶解法等。
(1) 酸碱溶解法
难溶酸常用强碱来溶解:H2SiO3(S)+2NaOH=Na2 SiO3+2H2O
难溶弱酸盐常用强酸或较强酸来溶解:CaC2O4(S)+2HCl= CaCl2+H2C2O4
难溶碱常用强酸(也可用较弱酸)来溶解:例如,向Mg(OH)2 沉淀中,加入酸或铵盐
(2) 发生氧化还原反应使沉淀溶解
有些金属硫化物如等,(CuS、HgS等)其溶度积特别小,在饱和溶液中C(S2-)特别少,不能溶于非氧化性强酸,只能溶于氧化性酸,以至减少C(S2-),达到沉淀溶解的目的。如:
3CuS+8HNO3=3Cu(NO3)+3S↓+2NO↑+4H2O
(3) 生成配合物使沉淀溶解:AgCl加氨水稳定的配合物[Ag(NH3)4]+减少其离子浓度,从而使沉淀溶解。
(4)沉淀转化溶解法:BaSO4的溶解。它不能为酸碱所溶解,又不易形成稳定的配离子,也不具有明显的氧化还原性,唯一的办法就是把它转化为一种新的难溶盐-弱酸钡盐(常使之转化为BaCO3),然后使之再溶于强酸。
试题枚举
[例1]298K,AgCl的溶解度为1.79×10-3g·L-1,试求该温度下AgCl的溶度积。
解析:已知AgCl的相对分子质量为143.4,则
AgCl溶解度为;  =1.25×10-5(mol·L-1)
=1.25×10-5(mol·L-1)
则: C(Ag+)=C(Cl-)=1.25×10-5mol·L-1
∴ ={C(Ag+/
={C(Ag+/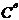 ){C(Cl-)/
){C(Cl-)/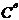 }=(1.25×10-5)2=1.56×10-10
}=(1.25×10-5)2=1.56×10-10
[例2]298K时,Ag2CrO4的 为9.0×10-12,求算Ag2CrO4的溶解度。
为9.0×10-12,求算Ag2CrO4的溶解度。
解析: Ag2CrO4(s) 2Ag+(aq)+CrO42-(aq)
2Ag+(aq)+CrO42-(aq)
设s为该温度下的溶解度(mol·L-1) 则:C(CrO42-)=s,C(Ag+)=2s
 ={C(Ag+)/
={C(Ag+)/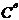 }2{C(CrO42-)/
}2{C(CrO42-)/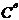 }
}
=(2s)2·x=9.0×10-12
s=1.31×10-4(mol·L-1)
从上二例可知:AgCl 的 比Ag2CrO4 的
比Ag2CrO4 的 大,但AgCl的溶解度反而比Ag2CrO4的小,这是由于两者的溶度积表示式类型不同。由此得出结论:虽然
大,但AgCl的溶解度反而比Ag2CrO4的小,这是由于两者的溶度积表示式类型不同。由此得出结论:虽然 也可表示难溶电解质的溶解能力大小,但只能用来比较相同类型的电解质,即阴离子和阳离子的总数要相同。
也可表示难溶电解质的溶解能力大小,但只能用来比较相同类型的电解质,即阴离子和阳离子的总数要相同。
4.沉淀的溶解
(1)对于在水中难溶的 ,如果能设法不断移去溶解平衡体系中的相应 ,使平衡向沉淀溶解的方向 ,就可以使沉淀溶解。
(2)CaCO3沉淀溶于盐酸中
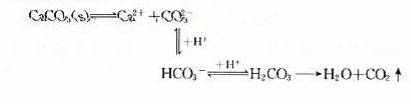
在上述反应中,CO2的生成和逸出,使CaCO3溶解平衡体系中的CO32-浓度不断 ,平衡向 方向移动。
(3)向3支盛有少量Mg(OH)2试管中分别滴加适量的蒸馏水、盐酸、氯化铵溶液,观察现象
|
滴加试剂 |
蒸馏水 |
盐酸 |
氯化铵溶液 |
|
现象 |
|
|
|
|
有关反应式 |
|
|
|
3.沉淀反应的应用
(1)在某些工业领域中,常用生成 来达到分离或除去某些离子的目的。
(2)如何除去工业原料氯化铵中的杂质氯化铁?
(3)要除去某溶液中的SO42-离子,加入可溶性钙盐还是钡盐?为什么?
(4)判断能否生成沉淀应从哪几个方面考虑?是否可以使要除去的离子全部通过沉淀除去?
2.溶解平衡的特征:
生成沉淀的离子反应的本质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com