
11. (本题12分)三聚氰胺是一种重要的化工原料,由于含氮量高而被一些奶粉厂家非法掺入奶粉中以提高其产品的含氮量。2008年三鹿牌等诸多婴幼儿奶粉中都查出了三聚氰胺,长期服用该奶粉的婴儿会得肾结石,严重则危及生命。
(本题12分)三聚氰胺是一种重要的化工原料,由于含氮量高而被一些奶粉厂家非法掺入奶粉中以提高其产品的含氮量。2008年三鹿牌等诸多婴幼儿奶粉中都查出了三聚氰胺,长期服用该奶粉的婴儿会得肾结石,严重则危及生命。
(1)  分子中所有原子最外层都满足8电子结构,请写出其结构式
;
分子中所有原子最外层都满足8电子结构,请写出其结构式
;
 中一个氰基(
中一个氰基( )被胺基(
)被胺基(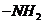 )取代后可得氰胺,氰胺电子式为 。
)取代后可得氰胺,氰胺电子式为 。
三个氰胺分子聚合成为三聚氰胺,请写出三聚氰胺的分子式 ;在三聚氰胺分子中存在类似于苯环结构的六元环,且三聚氰胺为非极性分子,试写出三聚氰胺的结构简式 ;
(2)目前工业合成三聚氰胺的原料是尿素,用硅胶为催化剂,在380℃-400℃条件下实现合成反应,反应中同时还生成 和
和 。四川某化工集团在同一厂区内以天然气、空气为原料,生产尿素、三聚氰胺等多种化工产品。若该集团以168吨氮气为原料全部用于合成三聚氰胺,假设每步反应中氮元素的转化率均为100%,则可生产
吨三聚氰胺。
。四川某化工集团在同一厂区内以天然气、空气为原料,生产尿素、三聚氰胺等多种化工产品。若该集团以168吨氮气为原料全部用于合成三聚氰胺,假设每步反应中氮元素的转化率均为100%,则可生产
吨三聚氰胺。
10. (本题9分)①H2C2O4+OH―=HC2O4―+H2O (1分)
(本题9分)①H2C2O4+OH―=HC2O4―+H2O (1分)
 ②c(HC2O4―) >c(H+)>c(C2O42―)>c(H2C2O4) (2分)
②c(HC2O4―) >c(H+)>c(C2O42―)>c(H2C2O4) (2分)
 ③a>b (2分)
③a>b (2分)
 ④变小(2分);
④变小(2分);
 因为溶液中存在如下平衡C2O42-+H2O
因为溶液中存在如下平衡C2O42-+H2O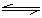 HC2O4-+OH―,当增大c(OH―)时,平衡向逆方向移动,n(C2O42-)的值变大,而n(K+)的值不变,故n(K+) / n(C2O42-)的值变小。(2分)
HC2O4-+OH―,当增大c(OH―)时,平衡向逆方向移动,n(C2O42-)的值变大,而n(K+)的值不变,故n(K+) / n(C2O42-)的值变小。(2分)
10.(本题9分)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol•L―1的H2C2O4溶液滴加0.01mol•L―1KOH溶液V(mL),回答下列问题。
 ①当V<10mL时,反应的离子方程式为
。
①当V<10mL时,反应的离子方程式为
。

 ②当V=10mL时,溶液中HC2O4―、C2O42―、H2C2O4、H+的浓度从大到小的顺序为
。
②当V=10mL时,溶液中HC2O4―、C2O42―、H2C2O4、H+的浓度从大到小的顺序为
。
 ③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42―)+c(HC2O4―);
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42―)+c(HC2O4―);
 当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42―)+c(HC2O4―)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42―)+c(HC2O4―)+c(H2C2O4);则a b(填“<”,“=”或“>”)。

 ④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是
。
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是
。
9.(本题10分)(2)用酒精棉消毒,再用注射器取家兔血 (2分)
 等量的血(1分)
A试管的血不凝固,B试管的血凝固(2分)
等量的血(1分)
A试管的血不凝固,B试管的血凝固(2分)
 等量的氯化钙溶液(1分)
A试管的血凝固,B试管的血仍凝固(2分)
等量的氯化钙溶液(1分)
A试管的血凝固,B试管的血仍凝固(2分)
 (3)作为A试管的对照,使实验成功(2分)
(3)作为A试管的对照,使实验成功(2分)
9.(本题10分)小明为探究血液中钙离子在血液凝固过程中起重要作用,查资料知道钙离子缺乏则不能凝固,草酸钾溶液能与血液中的钙离子发生反应,形成草酸钙沉淀,起抗凝作用。小明实验后证实该资料的结论是正确的。请根据小明的实验材料和用具,简要写出第二步及以后的实验步骤和实验结果,并回答问题。
 (1)实验材料和用具:①家兔 ②生理盐水 ③酒精棉 ④0.1mol/L的草酸钾溶液 ⑤0.1mol/L的氯化钙溶液 ⑥试管 ⑦注射器(针管、针头)。
(1)实验材料和用具:①家兔 ②生理盐水 ③酒精棉 ④0.1mol/L的草酸钾溶液 ⑤0.1mol/L的氯化钙溶液 ⑥试管 ⑦注射器(针管、针头)。
 (2)实验步骤和实验现象
(2)实验步骤和实验现象
 第一步:在A、B试管中分别加入等量的草酸钾溶液和生理盐水
第一步:在A、B试管中分别加入等量的草酸钾溶液和生理盐水
 第二步:
(2分)
第二步:
(2分)
 第三步:立即将 (1分)加入到A、B两试管中,可以观察到
(2分)
第三步:立即将 (1分)加入到A、B两试管中,可以观察到
(2分)
 第四步:将 (1分)溶液分别加入到A、B两试管中,可以观察到
(2分)
第四步:将 (1分)溶液分别加入到A、B两试管中,可以观察到
(2分)
 (3)设置B管的目的是
(2分)
(3)设置B管的目的是
(2分)
8.(22分)(1) N 第3周期第ⅦA族,.
 分子晶体
分子晶体
(3) ②④⑦ (3分。选对l个得l分,有错选的0分) .
 (4)
(4) 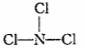 三角锥形
三角锥形
(5)H2O2+H2SO3=2H+
十S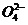 +H2O
+H2O
 (6)acd
(3分。选对1个得1分,有错选得0分)
(6)acd
(3分。选对1个得1分,有错选得0分)
(7)C12+H2S=S+2HCI (其余每空2分)
8.(22分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E
的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
请回答下列问题(填空时用实际符号):
(1)C的元素符号是 ;元素F在周期表中的位置 。
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 ,其固体时的晶体类型是 。
(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。
C4分子结构如右图所示,已知断裂lmolC-C吸收167kJ热量,生成1mo1C≡C放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
① C4属于一种新型的化合物
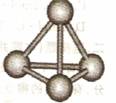 ② C4沸点比P4(白磷)低
② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量
④ C4与C2互为同素异形体
⑤ C4稳定性比P4(白磷)差
⑥ C4属于原子晶体
⑦ C4和P4 (白磷)的晶体都属于分子晶体
⑧ C4与C2互为同分异构体
(4) C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为 ,其空间构型为 。
(5) 为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6) E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是 。
a .E2F2的结构式为:F- E-E- F
b.E2F2为含有极性键 和非极性键的非极性分子
c. E2Br2与E2F2结构相似,熔沸点:E2Br2> E2F2
d. E2F2与H2O反应的化学方程式可能为:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(7) 举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):
7. 下列离子议程式书写正确的是( D )
 A.氟化钠溶于水:F-+H2O ═ HF+OH-
A.氟化钠溶于水:F-+H2O ═ HF+OH-
B.将氯气通入水中生成盐酸和次氯酸:Cl2+ H2O ═ 2H+ + Cl- + ClO-
C.用稀HNO3溶解FeS固体:FeS + 2H+ ═ Fe2+ + H2S↑
 D.明矾溶液与等物质的量的氢氧化钡溶液混合:
D.明矾溶液与等物质的量的氢氧化钡溶液混合:
3Ba2+ +6OH- + 2Al3+ + 3SO42- ═ 3BaSO4↓+ 2Al(OH)3↓
6. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是 ( D )
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)> c(OH-)>c(H+) 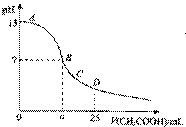
D.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
5.NA 代表阿伏加德罗常数,下列叙述错误的是C
A.一定温度下, 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含NH4+ 物
质的量不同
B.在 H2O2 + Cl2 = 2HCl + O2 反应中,每生成 32g氧气,则转移 2 NA 个电子
C.标准状况下,分子数为NA的CO 、N2 混合气体体积约为 22.4L,质量为28g
D.10 mL 质量分数为 98 %的 H2SO4,用水稀释至100 mL, H2SO4的质量分数为9.8 %
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com