
6、函数 的反函数是( )
的反函数是( )
A、 B、
B、
C、 D、
D、
5、已知圆 与圆
与圆 关于直线
关于直线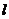 对称,则直线
对称,则直线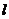 的方程为( )
的方程为( )
A、 B、
B、
C、 D、
D、
4、已知直线 、
、 与平面
与平面 、
、 ,给出下列三个命题( )
,给出下列三个命题( )
①若 ∥
∥ ,
,  ∥
∥ ,则
,则 ∥
∥ ;②若
;②若 ∥
∥ ,
, ⊥
⊥ ,则
,则 ⊥
⊥ ;
;
③若 ⊥
⊥ ,
, ∥
∥ ,则
,则 ;其中真命题的个数是:
;其中真命题的个数是:
A、0 B、1 C、2 D、3
3、 的值是( )
的值是( )
A、 B、
B、 C、
C、 D、
D、
2、两个非零向量 、
、 互相垂直,则下列结论中错误的一个是( )
互相垂直,则下列结论中错误的一个是( )
A、 B、
B、
C、 D、
D、
1、已知集合 ,
, ,
, ,则
,则 =( )
=( )
A. B.
B. C.
C. D.
D.
14.(15分)某化学反应:2AB+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验编号 |
时间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列问题:
(1)实验1中,反应在10-20 min时间内A的平均速率为________mol/(L·min).
(2)在实验2中,A的初始浓度c2=________mol/L,反应经20 min就达到平衡,可推测实验2中还隐含的条件是__________________________________________.
(3)设实验3的反应速率为v3,实验1的反应速率v1,则v3________v1,且c3________1.0 mol/L(填“>”、“=”、“<”).
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________.
解析:(1)v(A)=
=0.013 mol/(L·min).
(2)对比实验2与实验1可知,反应温度相同,达平衡时A的浓度相同,说明是同一平衡状态,即c2=1.0 mol/L,又因实验2反应的速率快,达平衡所需时间短,说明反应中使用了催化剂.
(3)对比实验3与实验1可知,从10 min到20 min,实验1中A的浓度变化值为0.13 mol/L,而实验3中A的浓度变化值为0.17 mol/L,这就说明了v3>v1.又知从0 min到10 min A的浓度变化值应大于0.17 mol/L,即c3>(0.92+0.17) mol/L=1.09 mol/L.
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4 的A浓度小,说明反应进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应.
答案:(1)0.013 (2)1.0 使用催化剂 (3)> >
(4)吸热 温度升高时,平衡向右移动
13.(11分)Fe3+和I-在水溶液中的反应如下:
2I-+2Fe3+2Fe2++I2(水溶液)
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,化学反应速率________(选填“增大”“减小”或“不变”),v正________v逆(填“>”、“<”或“=”),平衡________(填“向右”、“向左”或“不”)移动.
(2)上述反应的正反应速率和I-、Fe3+的浓度关系为:
v=k[c(I-)]m·[c(Fe3+)]n(k为常数).
c(I-)/mol/L c(Fe3+)/mol/L v/mol/(L·s)
① 0.20 0.80 0.032k
② 0.60 0.40 0.144k
③ 0.80 0.20 0.128k
通过所给的数据计算得知:
在v=k[c(I-)]m·[c(Fe3+)]n中,m、n的值为________.
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
I-浓度对反应速率的影响________(填“大于”、“小于”或“等于”)Fe3+浓度对反应速率的影响.
解析:(1)加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动.
(2)将表中的三组数据代入公式v=k[c(I-)]m·[c(Fe3+)]n得m和n的值分别为2和1.所以I-浓度对反应速率的影响大.
答案:(1)减小 > 向右 (2)C 大于
12.(16分)(2009·安徽高考)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表(表中不要留空格).
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3
mol/L |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |

[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图.
(2)请根据上图实验①曲线,计算降解反应50-150 s内的反应速率:
v(p-CP)=________mol/(L·s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________.
(4)实验③得出的结论是:pH等于10时,________.
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:_______________________
________________________________________________________________________.
解析:(1)依题意可知②的实验温度为313 K,实验对比是建立在其它条件相同前提下,故pH应与①的相同.若改变pH,其它条件不变可探究溶液pH对反应速率的影响.
(2)实验①曲线中,50-150 s时.
Δc(p-CP)=1.2×10-3 mol/L-0.4×10-3 mol/L=0.8×10-3 mol/L,所以v(p-CP)==8.0×10-6 mol/(L·s).
(3)在降解反应中,H2O2产生的自由基起氧化作用,温度过高,H2O2因热稳定性差而分解,导致降解反应速率下降.
(4)由曲线③可知,pH=10时,c(p-CP)基本不变,反应趋于停止.
(5)由(4)得到启示:在pH=10溶液中,反应速率趋于零,可将所取样加入NaOH溶液中(使pH=10);化学反应速率随温度降低而降低,故亦可用迅速大幅降温法.
答案:(1)
|
实验 编号 |
|
T/K |
pH |
c/10-3
mol/L |
|
|
H2O2 |
Fe2+ |
||||
|
① |
|
|
|
|
|
|
② |
|
313 |
3 |
6.0 |
0.30 |
|
③ |
探究溶液的pH对降解反应速率的影响 |
|
|
|
|
(2)8.0×10-6
(3)过氧化氢在温度过高时迅速分解
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
11.(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5 min后,测得D的浓度为0.5
mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5
mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol.
(2)B的平均反应速率v(B)=________mol/(L·min).
(3)x的值为________.
解析:(1) 3A(g) + B(g)  xC(g) + 2D(g)
xC(g) + 2D(g)
起始(mol) a a 0 0
5 min时(mol) a-1.5 a-0.5 0.5×2
=,解得a=3,即n(A)=n(B)=3 mol,
c(A)==0.75 mol/L.
(2)v(B)=
=0.05 mol/(L·min).
(3)v(C)==0.1 mol/(L·min),x=2.
答案:(1)0.75 3 (2)0.05 (3)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com