
10. 一定温度下,将
一定温度下,将 气体和1
气体和1  气体通入一密闭容器中,发生如下反应:
气体通入一密闭容器中,发生如下反应: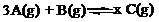 。请填写下列空白:
。请填写下列空白:
 (1)若容器体积固定为2L,反应2min时测得剩余0.6molB,C的浓度为0.1mol/L则:
(1)若容器体积固定为2L,反应2min时测得剩余0.6molB,C的浓度为0.1mol/L则:
 ① x = __________________;
① x = __________________;
 ②若反应经4min达到平衡,平衡时C的浓度_________0.8mol/L
②若反应经4min达到平衡,平衡时C的浓度_________0.8mol/L
 (填“大于”、“等于”、或“小于”)
(填“大于”、“等于”、或“小于”)
 ③平衡混合物中,C的体积分数为22%,则B的转化率是___________________;
③平衡混合物中,C的体积分数为22%,则B的转化率是___________________;
 ④改变起始物加入的量,欲使反应达到平衡时,C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量
n(A)、n(B)、n(C)之间应该满足的关系式为_____________
④改变起始物加入的量,欲使反应达到平衡时,C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量
n(A)、n(B)、n(C)之间应该满足的关系式为_____________
 ___________________;
___________________;
 (2)若维持容器压强不变,
(2)若维持容器压强不变,
 ①达到平衡时C的体积分数__________22%,(填“大于”、“等于”或“小于”)
①达到平衡时C的体积分数__________22%,(填“大于”、“等于”或“小于”)
 ②改变起始物质加入量,欲使反应达到平衡时,C的物质的量是原平衡的2倍,则A和B的起始物质的量分别应为_____________________________.
②改变起始物质加入量,欲使反应达到平衡时,C的物质的量是原平衡的2倍,则A和B的起始物质的量分别应为_____________________________.
0.01200L×0.010mol/L×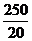 n2(Na2O2)
n2(Na2O2)
n2(Na2O2)=0.00375mol (3分)
n(Na2O2总)=0.01375mol (1分)
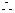 Na2O2%(纯度)=
Na2O2%(纯度)=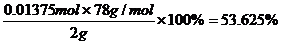 (1分)
(1分)
答:实验测得市售过氧化钠纯度为53.625%.
9.(18分)
(1)250mL容量瓶(1分,未标注体积不给分)
(2)生成气体体积为112mL(2分)
 ①温度必须恢复至原温度(1分)
①温度必须恢复至原温度(1分)
②移动量气瓶装置右管,使左右液面持平。(1分)
(3)偏低(2分):
事先在锥形瓶中加一些MnO2使H2O2分解 (2分)
(4)①酸式滴定管(1分)
②滴入最后一滴KMnO4溶液,紫红色半分钟内不褪色。(2分)
③解:生成O2为112mL,n(O2)=0.005mol
2Na2O2+2H2O 4NaOH+O2
2 l
nl(Na2O2) 0.005mol
 n1(Na2O2)=0.01mol (1分)
n1(Na2O2)=0.01mol (1分)
2KMnO4+5H2O2+3H2SO4 K2SO4+2MnSO4+5O2+8H2O
Na2O2+2H2O 2NaOH+H2O2
得关系式:2KmnO4 ~ 5H2O2 ~ 5Na2O2
2 5
9.(18分)某学习小组为测定市售过氧化钠纯度,设计了如下方案:
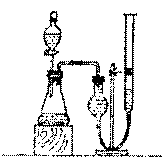 实验原理:2Na2O2+2H2O==4NaOH+O2↑(杂质不参与反应)
实验原理:2Na2O2+2H2O==4NaOH+O2↑(杂质不参与反应)
仪器装置:如右图。
 实验步骤:
实验步骤:
①称取过氧化钠样品2.00g;
②把过氧化钠样品放入气密性良好的
气体发生装置锥形瓶中
(固体体积忽略不计);
③向过氧化钠样品中滴加水,用量气装
置测得气体体积为166.00mL(已换算
成标准状况);
④锥形瓶中液体体积为54.00mL;
⑤将锥形瓶内液体全部转移入仪器A中,并定容至250.00mL;
请回答下列问题:
(1)仪器A的名称: ;
(2)生成气体的体积为 mL;为保证测定气体体积的准确性,测定时必须做到:
① ;② ;③视线与凹液面最低点持平。
(3)据报导,该反应还会有副反应:
Na2O2+2H2O===2NaOH+H202
H2O2生成,会使测定结果 (“偏高”、“偏低”、“无影响”)
如何避免因生成H2O2造成的误差: ;
(4)为效正实验结果.该小组补做了如下实验:
用滴定管量取20.00mL。A中的液体放人锥形瓶中,用0.010mol/L.的H2SO4酸化的高锰酸钾溶液滴定至终点,用去12.00ml.高锰酸钾溶液。其反应为:(未配平)
KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2+H2O
①滴定时高锰酸钾溶液应装在 中(填仪器名称)。
②此实验未使用指示剂,如何确定终点:
③由上述实验测定数据,计算该过氧化钠样品纯度(写出计算过程)。
8.(共15分,(2)中②电极反应2分,最后一空1分;方程式每空3分)

|
 (1)①Cu2(OH)2CO3===2CuO+H2O+CO2↑
(1)①Cu2(OH)2CO3===2CuO+H2O+CO2↑

|
|
 ②C+2CuO ===2Cu+CO2↑或C+CuO===Cu+CO↑
②C+2CuO ===2Cu+CO2↑或C+CuO===Cu+CO↑

 (2)①Cu+2Fe3+==Cu2++2Fe2+ ②Fe3++e- == Fe2+,石墨、或柏、或惰性材料
(2)①Cu+2Fe3+==Cu2++2Fe2+ ②Fe3++e- == Fe2+,石墨、或柏、或惰性材料
 (3)Cu2(OH)2CO3+4H+===2Cu2+
+3H2O+CO2↑
(3)Cu2(OH)2CO3+4H+===2Cu2+
+3H2O+CO2↑
8.(15分)孔雀石(主要成分为Cu2(OH)2CO3)是一种常见的铜矿石。人类很久以前就发现在木材堆中炊烧孔雀石后,余烬里会含有一种红色光亮的金属。
(1)写出孔雀石在上述变化中发生的两个化学反应方程式:
① ;
② 。
(2)取上述过程中得到的红色光亮金属,加入FeCl3溶液,光亮金属可以溶解。
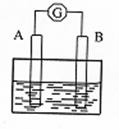 ①写出该金属与FeCl3溶液发生反应的离子方程式:
①写出该金属与FeCl3溶液发生反应的离子方程式:
;
②将①中的反应设计成原电池(如图)。若A极上
发生了氧化反应,则B极的电极反应式为:
;
B电极的材料可选用 (填一种即可)。
(3)将少量孔雀石用浓硝酸溶解,过滤后得到一种蓝色溶液,该反应的离子方程式是
。
7. 下列反应的离子方程式书写正确的是D
下列反应的离子方程式书写正确的是D

 A.向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
A.向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
 B.将碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O
B.将碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O
 C.将1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积均匀混合:
C.将1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积均匀混合:
 AlO2- + H+ + H2O = Al(OH)3↓
AlO2- + H+ + H2O = Al(OH)3↓
 D.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+ 恰好完全沉淀
D.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+ 恰好完全沉淀
 2Al3++3SO42-+3Ba2++6OH- = 2Al(OH)3↓+3BaSO4↓
2Al3++3SO42-+3Ba2++6OH- = 2Al(OH)3↓+3BaSO4↓
6. 下列各装置中,夹紧②、③、④中的弹簧夹,并作相关操作,会漏气的装置是:A
下列各装置中,夹紧②、③、④中的弹簧夹,并作相关操作,会漏气的装置是:A


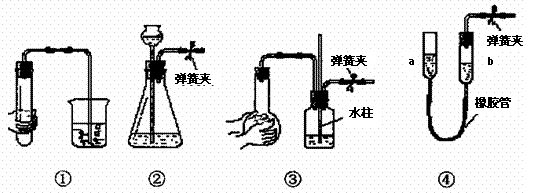 A.对装置①,双手移去后.导管中水面与烧杯水面相平
A.对装置①,双手移去后.导管中水面与烧杯水面相平
 B.对装置②,长颈漏斗内液面高度保持不变
B.对装置②,长颈漏斗内液面高度保持不变
 C.对装置③,长导管内形成一段水柱
C.对装置③,长导管内形成一段水柱
 D.对装置④,上移a管后,a、b两端液面形成了一段稳定的高度差
D.对装置④,上移a管后,a、b两端液面形成了一段稳定的高度差
5.化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是 ( B )
 ①鸡蛋白溶液遇浓硝酸--黄色 ②淀粉碘化钾溶液遇碘离子--蓝色
①鸡蛋白溶液遇浓硝酸--黄色 ②淀粉碘化钾溶液遇碘离子--蓝色
 ③溴化银见光分解--白色 ④热的氧化铜遇乙醇--红色
③溴化银见光分解--白色 ④热的氧化铜遇乙醇--红色
 ⑤新制氯水久置后--无色 ⑥过氧化钠在空气中久置--淡黄色
⑤新制氯水久置后--无色 ⑥过氧化钠在空气中久置--淡黄色
 A.①②③⑤ B.①④⑤ C.②③④⑥ D.④⑤⑥
A.①②③⑤ B.①④⑤ C.②③④⑥ D.④⑤⑥
4. 取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8(25℃),则下列说法(或关系式)正确的是 ( C )
A.混合溶液中由水电离出的c(OH¯)<0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
D.c(OH¯)-c(HX) = c(H+) = 1×10-6mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com