
17.(8分)在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
|
|
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于水的时间/s |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
35 |
t1 |
|
E |
2 |
细小颗粒 |
15 |
t2 |
|
F |
2 |
粉末 |
15 |
t3 |
|
G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1=________s,画出以时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(2)利用所画的曲线图,总结并得出的关于温度影响反应速率的结论是_____________________________________________________.
(3)t1________t4(填“>”或“<”),原因是________________________________
________________________.
t2________t3(填“>”或“<”),原因是_______________________________
__________________________.
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为___________.
解析:解答该题要认真分析表中数据.由A、B、C总结规律,推出t1=50 s,根据A、B、C、D四组实验的数据可画出温度-时间图.通过对图象的分析总结温度对反应速率的影响,找出规律.D、G组实验相比较,G中可形成铜-锌原电池,加快反应速率;E、F组实验相比较,F中锌的表面积大,速率快;B、E、F组相比较,粉末状的Zn反应速率最快,薄片状的Zn反应速率最慢,故单位时间内消耗锌的质量为mF>mE>mB.
答案:(1)50
如图所示:
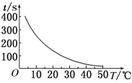
(2)温度每升高10℃,反应速率加快到原来的2倍
(3)> G组中可形成Cu-Zn原电池,反应速率加快
> F组中锌为粉末状,表面积较大,反应速率加快
(4)mF>mE>mB
16.(2009·靖江模拟)常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4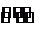 2NO2 ΔH>0)
2NO2 ΔH>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
解析:将两容器置于沸水中加热时,甲容器中平衡正向移动,使容器中气体的物质的量增大,所以容器的体积甲>乙;在活塞上都加2 kg的砝码时,甲容器中平衡逆向移动,使容器中气体的物质的量减小,所以容器的体积甲<乙.
答案:D
15.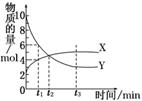 (2010·蚌埠模拟)一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如右图.下列叙述中正确的是
( )
(2010·蚌埠模拟)一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如右图.下列叙述中正确的是
( )
A.反应的化学方程式为5YX
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
解析:反应开始时Y为10 mol,X为2 mol,达到平衡时Y减少了7 mol,X增多了3 mol,因此反应方程式是7Y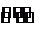 3X,A不正确;t1时,Y为6 mol、X为4 mol,其物质的量比为3∶2,即Y的浓度是X浓度的1.5倍,B正确.从图象可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,D不正确.
3X,A不正确;t1时,Y为6 mol、X为4 mol,其物质的量比为3∶2,即Y的浓度是X浓度的1.5倍,B正确.从图象可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,D不正确.
 答案:B
答案:B
14.(2010·徐州模拟)在容积为2 L的密闭容器中,有反应:mA(g)+nB(g) 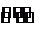 pC(g)+qD(g),经过5 min达到平衡,此时,各物质的变化为A减少了a mol/L,B的平均反应速率vB=a/15 mol/(L·min),C增加了2a/3
mol/L,这时,若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为
( )
pC(g)+qD(g),经过5 min达到平衡,此时,各物质的变化为A减少了a mol/L,B的平均反应速率vB=a/15 mol/(L·min),C增加了2a/3
mol/L,这时,若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为
( )
A.3∶1∶2∶2 B.1∶3∶2∶2
C.1∶3∶2∶1 D.1∶1∶1∶1
解析:因为5 min内vB=a/15 mol/(L·min),C增加了2a/3 mol/L,所以vC=2a/15 mol/(L·min),即n∶p=1∶2,符合这一关系的只有A.
答案:A
13.某温度下,反应H2(g)+I2(g) 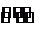 2HI(g)的正反应为放热反应,在带有活塞的密闭容器中达到平衡.下列说法中正确的是
( )
2HI(g)的正反应为放热反应,在带有活塞的密闭容器中达到平衡.下列说法中正确的是
( )
A.体积不变,升温,正反应速率减小
B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氮气后,正反应速率将增大
解析:升高温度,正反应、逆反应速率都增大;该反应属于反应前后气体体积不变的反应,压缩体积,平衡不移动,但其中物质的浓度增大,因为I2(g)的存在,颜色加深; 温度、压强均不变,充入HI气体,开始时正反应速率不变.
答案:C
12.X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y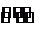 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
( )
A.33% B.40%
C.50% D.65%
解析:由题意可取X和Y各1 mol,设X的转化量为a mol
X + 2Y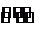 2Z
2Z
起始:1 mol 1 mol 0
转化:a mol 2a mol 2a mol
平衡:(1-a)mol (1-2a)mol 2a mol
到达平衡后,反应物的总物质的量与生成物的总物质的量之比为3∶2,即[(1-a)mol+(1-2a)mol]∶2a mol=3∶2,解得a=1/3.则Y的转化率=2a mol/1 mol=2/3,最接近65%.
答案:D
11.(2009·山东高考)2SO2(g)+O2(g) 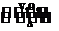 2SO3(g)是制备硫酸的重要反应.下列叙述正确的是
( )
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是
( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为v=
解析:A项,催化剂能同等程度地改变正、逆反应速率,A项错误;B项,在恒容的条件下,通入惰性气体,压强增大,但各物质的浓度不变,则反应速率不变,故B项错误;C项,降低温度,反应速率也降低,反应达到平衡的时间就长,故C项错误.
答案:D
10. (2009·北京高考)已知:H2(g)+I2(g) 2HI(g) ΔH<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
(2009·北京高考)已知:H2(g)+I2(g) 2HI(g) ΔH<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
解析:0.2 mol HI相当于H2、I2各0.1 mol,所以甲、乙两容器中在题述情况下达到的平衡是等效的.A项,甲、乙提高相同温度,仍等效;B项,甲中加入0.1 mol He对反应无影响;C项,甲降低温度,平衡右移,HI的浓度增大;D项,甲增加0.1 mol H2,乙增加0.1 mol I2,平衡都向右移动,HI的浓度都增大,具体结果不能确定.
答案:C
9.(2009·重庆高考)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
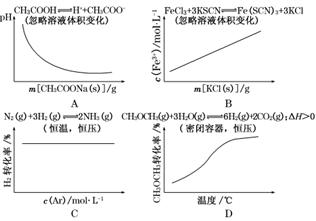
解析:A项,加入CH3COONa,使CH3COOH的电离平衡逆向移动,c(H+)减小,pH增大;B项,加入KCl,对平衡没有影响,c(Fe3+)不变;C项,加入Ar气,在恒温、恒压下,体积增大,平衡左移,H2转化率减小,D项,所给反应是吸热反应,升高温度,平衡右移,反应物转化率增大,正确.
答案:D
8.

 在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
     |
CO2 |
H2 |
CO |
H2O |
|
甲 |
a mol |
a mol |
0 mol |
0 mol |
|
乙 |
2a mol |
a mol |
0 mol |
0 mol |
|
丙 |
0 mol |
0 mol |
a mol |
a mol |
|
丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
解析:根据可逆反应的特征,甲和丙,乙和丁分别为相同的平衡状态,达到平衡后n(CO)相同;甲和乙相比较,乙中增加了CO2的物质的量,平衡正向移动,n(CO)增加,所以乙=丁>丙=甲.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com