
3.近两年,由于多方面的原因,国际石油价格持续上涨,与石油相关的一些生产、生活用品价格也随之上涨。下列关于石油的说法正确的是( )
A.石油的蕴藏量是无限的
B.石油是一种重要的纯净物
C.石油是一种由多种物质组成的混合物
D.石油经过干馏后的产品,可用作汽车燃料
2.食用下列食品,通常不会对人体健康造成危害的是( )
A.用工业食盐腌制的咸肉 B.含有“苏丹红四号”的红心鸭蛋
C.已经有些霉变的大米或花生 D.牛奶经工业发酵后得到的酸奶
1.古诗词是古人为我们留下的宝贵精神财富。下列诗句中只涉及物理变化的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.只要工夫深,铁杵磨成针 D.粉身碎骨浑不怕,要留清白在人间
0.4 mol 0.8 mol
v(CH3OH)==0.01 mol/(L·s).
(3)①B容器的体积变为原来的1.5倍,增加的气体的物质的量为3.6 mol×0.5=1.8 mol,则反应的甲醇的物质的量为0.9 mol,CH3OH的转化率为×100%=75%.容器B中的压强小于A,故反应物的转化率高,H2O的体积百分含量小.
②设打开K重新达到平衡后总的体积为x,则=
求得x=2.75a,所以B的体积为2.75a-a=1.75a.
答案:(1)0.01 mol/(L·s) (2)③④ (3)①75% <
②1.75a
22.(9分)(2009·北京海淀期末)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) 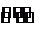 CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________.
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________.
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答:
①反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为________;A、B两容器中H2O(g)的体积百分含量的大小关系为:B________A(填“>”“<”或“=”).
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响).
解析:(1)此题宜采用差量法计算,压强之比等于物质的量之比,反应后增加的气体的物质的量为4 mol×0.2=0.8 mol,
CH3OH(g)+H2O(g) 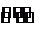 CO2(g)+3H2(g) Δn
CO2(g)+3H2(g) Δn
1 2
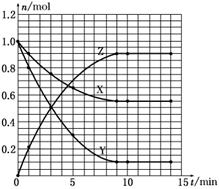
21.(8分)(2009·全国卷Ⅱ)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
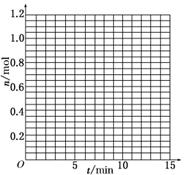
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是____________________________________;
(3)列式计算该反应在0-3 min时间内产物Z的平均反应速率:________;
(4)该反应达到平衡时反应物X的转化率α等于________;
(5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:
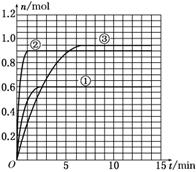
1________,2________,3________.
解析:(2)由表中数据可知X、Y、Z是以1∶2∶2的比例进行反应的,且9 min以后各物质的物质的量不发生变化也均不为零,则该反应是可逆反应,反应方程式为:
X+2Y 2Z.
2Z.
(3)v(Z)===0.083 mol/(L·min).
(4)α(X)=×100%=×100%=45%.
(5)对比曲线1和表中数据可知:曲线1达到平衡所用时间短(2 min),且生成的Z较少,即相对原平衡来说是增大了反应速率且平衡向逆向移动,故曲线1改变的条件是升高了温度.对比曲线2和表中数据可知:曲线2达到平衡所用时间短(1 min),但生成Z的量不变,即加快了反应速率但平衡没有移动,故曲线2改变的条件是加入了催化剂.对比曲线3和表中数据可知:曲线3达到平衡所用时间短(7 min),且平衡时生成Z的量增多(0.95 mol),即加快了反应速率且平衡向正向移动,故曲线3改变的条件是增大压强.
答案:(1)
(2)X+2Y 2Z (3)=0.083 mol/(L·min)
2Z (3)=0.083 mol/(L·min)
(4)45% (5)升高温度 加入催化剂 增大压强
0.84 K1=K2=K3=K4<K5
(3)2A(g)+B(g)  3C(g) ΔH=+200a kJ/mol
3C(g) ΔH=+200a kJ/mol
(4)a+2c/3=2.4,b+c/3=1.2
20.(9分)(2009·烟台模拟)向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段使用了催化剂;图一中t0-t1阶段c(B)未画出.
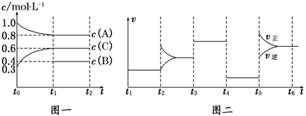
(1)若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=________.
(2)t4-t5阶段改变的条件为________,B的起始物质的量为________.各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1=________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________(用“>”、“<”或“=”连接).
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:__________________________.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为______________.
解析:(1)利用公式求解,
v(C)==0.02 mol/(L·min).
(2)t2-t3过程是增加了一种反应物的浓度;t3-t4是加入了催化剂;t4-t5平衡没有移动,只能是减小了压强,由此推断反应前后气体的体积不变,根据速率之比等于化学方程式中各物质的计算数之比得反应方程式2A+B3C,又可推知,Δc(B)=0.1 mol/L,B的起始浓度c(B)=0.5 mol/L,则n(B)=c(B)·V=0.5 mol/L·2 L=1 mol,K1===0.84;t5-t6过程中升高温度时,正反应速率和逆反应速率都增大.所以,K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5,前四个过程温度不变平衡常数也不变,升温平衡右移,故而平衡常数变大.
(3)书写热化学方程式时要注意化学计量数必须与ΔH相对应,如果化学计量数加倍,ΔH也要加倍.
(4)此时的平衡和t1时刻的平衡是同一个平衡,t1时刻若是全转化为反应物,则A、B、C的物质的量分别是2.4 mol、1.2 mol、0 mol现作同样转化
2A + B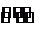 3C
3C
开始(mol) a b c
相当于(mol) a+c b+ 0
则a+c=2.4,b+=1.2.
答案:(1)0.02 mol/(L·min) (2)减小压强 1.0 mol
19.(9分)在一个温度恒定的密闭容器中,SO2和O2发生反应.已知1 mol SO2和足量O2完全反应,放出的热量为Q.请按要求回答下列问题.
[恒压条件下]
(1)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成0.9 mol SO3,这时SO2的转化率为________.
(2)若开始时放入4 mol SO2和2 mol O2,达平衡后,生成SO3的物质的量为________,反应放出的热量为________.
[恒容条件下]
(3)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成a mol SO3,则a________0.9(填“>”、“<”或“=”).
(4)若令x、y和z分别代表初始加入SO2、O2和SO3的物质的量,要使达平衡时,反应混合物中三种气体的物质的量分别与(3)中平衡时完全相同,则x、y、z必须满足的一般条件是______________________________.(用两个代数式表式,其中一个只含x、y,另一个含x、z).
解析:(1) 2SO2 + O2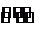 2SO3
2SO3
起始(mol) 1 0.5 0
转化(mol) 0.9 0.45 0.9
平衡(mol) 0.1 0.05 0.9
SO2转化率为90%.
(2)恒温恒压下,只要转化为相同物质后的起始投入量成比例,两者就成等效平衡,SO2转化率相同,生成SO3为4 mol×90%=3.6 mol,放出热量为3.6Q.
(3)恒容条件下,由于该反应是气体体积减小的反应,所以相对于恒压条件,相当于气体体积增大,压强减小,平衡向气体体积增大的方向移动,SO2转化率降低,则生成SO3小于0.9 mol.
(4) 2SO2 + O2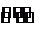 2SO3
2SO3
1 0.5 0
起始 x y z
变化 z 0.5z z
平衡 x+z y+0.5z 0
则x+z=1,y+0.5z=0.5,即x=2y,x+z=1.
答案:(1)90% (2)3.6 mol 3.6Q (3)<
(4)x=2y,x+z=1
18.(9分)在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4)/mol/L |
0.100 |
c1 |
0.050 |
c3 |
c4 |
|
c(NO2)/mol/L |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为______________________;从表中数据分析:c1________c2;c3________c4(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
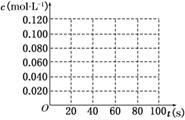
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为________mol/(L·s).
(4)达平衡后下列条件的改变可使NO2气体浓度增大的是________.
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(5)若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为________.
解析:(1)该反应的化学方程式为N2O4(g)  2NO2(g),其平衡常数表达式为K=;由表中数据可求得c1=0.070 mol/L,c2=0.100 mol/L,c1<c2,反应至60 s时已达到化学平衡状态,因此c3=c4.
2NO2(g),其平衡常数表达式为K=;由表中数据可求得c1=0.070 mol/L,c2=0.100 mol/L,c1<c2,反应至60 s时已达到化学平衡状态,因此c3=c4.
(3)由表中信息得从反应开始至达到化学平衡时NO2的反应速率为=0.002 mol/(L·s),v(N2O4)=v(NO2)/2=0.001 mol/(L·s).
(4)增大容器的容积不管平衡如何移动,反应物和生成物的浓度均减小,A错误.平衡后再充入一定量的N2O4,平衡正向移动,NO2的浓度增大,B正确.分离出一定量的NO2,虽然平衡正向移动,但NO2气体的浓度减小,C错误.在容器容积不变的情况下再充入稀有气体He,反应物和生成物的浓度均不变,化学平衡不移动,NO2气体的浓度不变,D错误.
(5)在题设条件下反应N2O4(g)2NO2(g)的平衡常数K===0.36,现充入NO2气体0.080 mol,相当于0.040 mol N2O4,设达平衡时转化了x mol/L的N2O4,则有K===0.36,解得x=0.030,即达到平衡时混合气体中有0.060 mol NO2和0.010 mol N2O4,即NO2的转化率为25%.
答案:(1)K= < =
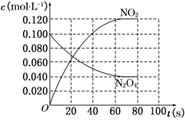
(2)
(3)0.001 (4)B (5)25%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com