
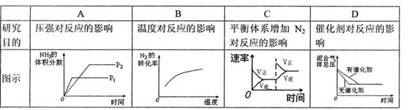
10.对于可逆反应N2(g)+3H2(g)=2NH3(g) △H<0,下列研究目的和图示相符的是( )
9.为了测定酸碱反应的中和热,计算时至少需要的数据是 ( )
①酸的浓度和体积 ②碱的浓度和体积
③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部
8.一定条件下,将10 mol H2和1 mol N2充入一密闭容器中,发生反应:N2(g)+3H2(g) 2NH3(g),达到平衡时,H2的转化率可能是 ( )
2NH3(g),达到平衡时,H2的转化率可能是 ( )
A.25% B.30% C.35% D.75%
7.在2A+B=3C+4D反应中,表示该反应速率最快的数据是 ( )
A.υA = 0.5mol·L-1·s-1 B.υB = 0.3mol·L-1·s-1
C.υC = 0.8mol·L-1·s-1 D.υD = 1.0mol·L-1·s-1
6.反应2A(g) 2B(g)+E(g) △H>0, 达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 ( )
2B(g)+E(g) △H>0, 达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 ( )
A.加压 B.减压 C.减少E的浓度 D.降温
5.知道了某过程有自发性之后,则 ( )
A.可判断出过程的方向 B.可确定过程是否一定会发生
C.可预测过程发生完成的快慢 D.可判断过程的热效应
4.下列说法正确的是 ( )
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
3.本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是: ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
2.绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是: ( )
① 太阳能 ② 风能 ③ 石油 ④ 煤 ⑤ 潮汐能 ⑥ 木材
A.①②③ B.③④⑤ C.④⑤⑥ D.①②⑤
1.下列与化学反应能量变化相关的叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.根据盖斯定律,可计算某些难以直接测定的反应焓变
D.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com