
2.在新陈代射过程中,起重要作用的两种物质是( )
A、有机酸和糖类 B、酶和ATP C、核酸和ATP D、蛋白质和核酸
1.一般情况下,动物体内的主要能源物质、直接能源物质、储备能源物质依次是( )
A.糖类、蛋白质、脂肪 B.ATP、糖类、脂肪
C.糖类、ATP、脂肪 D.糖类、ATP、蛋白质
22.(9分)某反应过程中的能量变化如图所示:
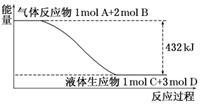
(1)写出该反应的热化学方程式:_________________________________________
_______________________________________________________________.
(2)在溶液中进行化学反应中的物质,其状态标为“aq”,已知0.5 mol H2SO4在溶液中与足量氢氧化钠反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式:____________________________________________________________
________________________________________________________________________.
(3)合成氨反应的热化学方程式:
N2(g)+3H2(g)2NH3(g) ΔH=-92.2 kJ/mol
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol.
解析:(1)由图可知,反应物总能量高于生成物总能量,可判断所给反应是一个放热反应,据图可写出反应的热化学方程式.
(3)据热化学方程式可知,1 mol N2完全反应才能得到92.2 kJ的热量,而N2转化率为10%,则实际需要投入10 mol N2才能转化1 mol N2.
答案:(1)A(g)+2B(g)===C(l)+3D(l)
ΔH=-432 kJ/mol
(2)H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ/mol
(3)10
(3)P(s)+O2(g)===P2O3(s)
ΔH=-(20X-Y) kJ/mol
21.(10分)近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注.该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景.已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量.
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况)的CO2能合成CH3OH气体的物质的量是________,此过程中能放出热量________ kJ.
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则22 g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为________.
(4)根据该反应特点,有利于甲醇合成的条件是________.
A.高压高温 B.低压高温
C.高压低温 D.低压低温
解析:(1)4.4 g CO2气体完全合成CH3OH和水蒸气放热4.95 kJ,则1 mol CO2完全合成CH3OH和水蒸气放热49.5 kJ,热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.5 kJ/mol.
(2)n(CH3OH)=n(CO2)=×22%=44 mol,每生成1 mol CH3OH(g)放热49.5 kJ,则此过程中放热为:(44×49.5)kJ=2178 kJ.
(3)由H2O(g)===H2O(l) ΔH=-44 kJ/mol以及(1)中的热化学方程式可知,1 mol CO2完全合成CH3OH并生成液态水时放热为44 kJ+49.5 kJ=93.5 kJ.则22 g CO2即0.5 mol CO2与H2反应时,放热为93.5 kJ÷2=46.75 kJ.
(4)该反应正反应放热,低温有利于CO2合成CH3OH,又因正反应为体积减小的反应,高压有利于CO2合成CH3OH.
答案:(1)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH=-49.5 kJ/mol
(2)44 mol 2178
(3)46.75 kJ (4)C
20.(10分)(2009·福州质检)磷在氧气中燃烧,可能生成两种固态氧化物3.1 g的单质磷(P)在3.2 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是________________,其相应的质量(g)为______________________________________________________________.
(2)已知单质磷的燃烧热为Y kJ/mol,则1 mol P与O2反应生成固态P2O3的反应热ΔH=________________________________________________________________.
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式:
________________________________________________________________________.
解析:根据题意由质量守恒定律设反应生成P2O3 x mol,P2O5 y mol,则有
,解得:
所以反应生成P2O3:0.025 mol×110 g/mol=2.75 g
P2O5:0.025 mol×142 g/mol=3.55 g
根据燃烧热的概念,可知燃烧生成0.5 mol P2O5放热Y kJ,所以生成0.025 mol P2O3.放出热量为:
X kJ-×0.025=(X-0.05Y) kJ,由此可推算出其余问题的答案.
答案:(1)P2O3、P2O5 2.75 g、3.55 g
19.(9分)(2008·海南高考)反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
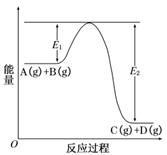
(1)该反应是______________________反应(填“吸热”“放热”).
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”“不变”),原因是__________________________________________________________,
___________________________________________________________________.
(3)反应体系中加入催化剂对反应热是否有影响?______原因是
__________________________________________________________________.
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”“减小、”“不变”).
解析:由图可以看出,反应物的总能量高于生成物的总能量,故该反应是放热反应.催化剂是通过降低活化能(E)提高活化分子的百分含量来加快化学反应速率的,但不影响化学平衡状态(或化学平衡不移动).
答案:(1)放热
(2)减小 根据勒夏特列原理,升高温度有利于反应向吸热反应方向移动,因而该反应中A的转化率减小
(3)没有 催化剂只能改变化学反应的速率和途径,不能改变化学反应的始态和终态的能量,因此对反应热没有影响
(4)减小 减小
18.(6分)已知:在热力学标准态(298 K、1.01×105Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
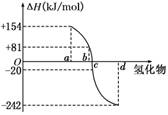
(1)写出氧族元素中含有18e-的两种氢化物的电子式:
___________________________________________________________________.
(2)请你归纳:非金属元素氢化物的稳定性与其反应热ΔH的关系
_____________________________________________________.
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应式:
________________________________________________________________________.
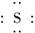
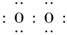 解析:(1)氧族元素包括O、S、Se、Te,含18e-的氢化物有H2O2和H2S,它们的电子式分别为H? ?H,H ?H.
解析:(1)氧族元素包括O、S、Se、Te,含18e-的氢化物有H2O2和H2S,它们的电子式分别为H? ?H,H ?H.
(2)据生成热的数据示意图知,ΔH越小,说明生成对应的氢化物时放出热量越多,生成的氢化物越稳定,所以a、b、c、d分别代表碲、硒、硫、氧.
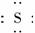
 (3)因生成1 mol H2Se时吸收81 kJ的热量,那么当1 mol H2Se分解时放出81 kJ的热量,其热化学方程式可表示为H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ/mol.
(3)因生成1 mol H2Se时吸收81 kJ的热量,那么当1 mol H2Se分解时放出81 kJ的热量,其热化学方程式可表示为H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ/mol.
答案:(1)H H、H? H
(2)非金属元素氢化物越稳定,ΔH越小,反之亦然
(3)H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ/mol
17.(8分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式___________________
________________________________________________________________________.
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________________________________________________________.
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________________________________________.
解析:(1)由中和热的定义可知,1 mol NaOH与 mol H2SO4反应生成1 mol水时放热57.3 kJ.
(2)CO2通入澄清石灰水中产生25 g白色沉淀,即n(CO2)=0.25 mol,则n(C4H10)= mol,1 mol丁烷完全燃烧放出热量16Q kJ.
(3)合成CH3COOH的反应为:
2C(s)+2H2(g)+O2(g)===CH3COOH(l)
根据盖斯定律,②×2+③×2-①得,
ΔH=(-393.5 kJ/mol)×2+(-285.8 kJ/mol)×2-(-870.3 kJ/mol)=-488.3 kJ/mol.
答案:(1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)ΔH=-16Q kJ/mol
(3)2C(s)+2H2(g)+O2(g)===CH3COOH(l)
ΔH=-488.3 kJ/mol
16.用CH4催化还原NOx可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ/mol
下列说法不正确的是 ( )
A.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH>-574 kJ/mol
B.反应①②转移的电子数相同
C.若用标准状况下4.48 L CH4还原NO2至N2同时生成气态水,放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2到N2,整个过程中转移电子1.60 mol
解析:水蒸气冷凝为液态水需要释放能量,所以CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ/mol.
答案:A
15.在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立平衡:2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ/mol测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
A.1.8Q kJ B.2Q kJ
C.Q kJ D.0.9Q kJ
解析:热化学方程式的含义是指2 mol SO2完全反应放出Q kJ热量,现有4 mol SO2,且转化率为90%,则产生的热量与反应物的量相对应,放出的热量为×Q kJ×90%=1.8Q kJ.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com