
18.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
17.已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:
2CrO42-(黄色)+2H + 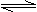
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
若要使溶液的橙色加深,下列可采用的方法是 ( )
A.加入适量稀盐酸 B.加入适量稀硝酸
C.加入适量烧碱固体 D.加水稀释
16.在某恒温恒容的密闭容器内发生反应:2A(g)+B(g) C(g);ΔH<0 。开始充入2 mol A和2 mol B,并达到平衡状态,下列说法正确的是
C(g);ΔH<0 。开始充入2 mol A和2 mol B,并达到平衡状态,下列说法正确的是
A.再充入2 mol A,平衡正移,A的转化率增大
B.如果升高温度,C的体积分数增大
C.如果增大压强,平衡正移,B的体积分数减小
D.再充入1 mol C和1 mol B,C的体积分数将增大
15.当把晶体N2O4放入密闭容器中气化,并建立了N2O42NO2平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,其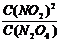 比值 ( )
比值 ( )
A.变大 B.不变 C.变小 D.无法确定
14.某温度下,在一体积恒定的密闭容器内发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是 ( )
C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是 ( )
A.气体的压强 B.气体的总物质的量
C.气体的平均密度 D.气体的平均相对分子质量
13.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键能之和的差。
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1mol化学键时放出的能量 |
436kJ |
243kJ |
431kJ |
则下列化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-91.5kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g);△H=-183kJ·mol-1
C.1/2H2(g)+1/2Cl2(g)=HCl(g);△H=+91.5kJ·mol-1
D.2HCl(g) =H2(g)+Cl2(g) ;△H=+183kJ·mol-1
12.在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g) =CO(g) ΔH1=-110.5 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(g) ΔH2=-241.7 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
下列说法正确的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.2 kJ·mol-1
B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.2H2O(g)=2H2(g)+O2(g) ΔH=-483.4 kJ·mol-1
D.H2O(g)=H2O(l) ΔH=-44.1 kJ·mol-1
11.我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是 ( )
A.反应进行的方向 B.反应的快慢
C.反应进行的限度 D.反应物的多少
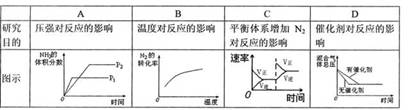
10.对于可逆反应N2(g)+3H2(g)=2NH3(g) △H<0,下列研究目的和图示相符的是( )
9.为了测定酸碱反应的中和热,计算时至少需要的数据是 ( )
①酸的浓度和体积 ②碱的浓度和体积
③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com