
13. 反应11P+15CuSO4+24H2O 5Cu3P+6H3PO4+15H2SO4中32gCuSO4能氧化磷的质量为(A)
A. 1.24 g
B: 1. 364 g C. 3.1 g
D. 4.24 g
12. 某气态烃1 mol跟2 mol氯化氢加成,其加成产物又可被8 mol氯气完全取代,该烃可能是(D)
 A. 丙烯
B. 乙烯
C. 丙炔
D. 2-丁炔
A. 丙烯
B. 乙烯
C. 丙炔
D. 2-丁炔
11.

 不久前,某海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+CO
不久前,某海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+CO -2e- H2O+CO2,则下列推断正确的是(B)
-2e- H2O+CO2,则下列推断正确的是(B)
A. 正极反应为:4OH- O2+2H2O+4e-
B. 放电时CO 向负极移动
向负极移动
C. 电池供应1 mol水蒸气,转移电子4 mol
D. 氢氧燃料电池的H2和O2都贮存在电池中
10. 在l01 kPa时,l mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热。一些烷烃的燃烧热如下表,则下列表述正确的是(A)
|
|
燃烧热 |
|
燃烧热 |
|
烷烃 |
|
烷烃 |
|
|
|
/(kJ·mol-1) |
|
/(kJ·mol-1) |
|
甲烷 |
890.1 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
A. 正戊烷的燃烧热约为3540 kJ·mol-1
 B. 热稳定性:正丁烷>异丁烷
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g) 4CO2(g)+6H2O(l);ΔH=-1560.8 kJ/mol
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多

9. 为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是(B)
|
序号 |
物质 |
杂质 |
除杂质应选用的试剂或操作方法 |
|
① |
KNO3溶液 |
KOH |
滴入稀盐酸,同时用pH计测定至溶液呈中性 |
|
② |
FeSO4溶液 |
CuSO4 |
加入过量铁粉并过滤 |
|
③ |
H2 |
CO2 |
依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
|
④ |
Na2SO4 |
CaCO3 |
溶解、过滤、蒸发、结晶 |
A. ①②③
B. ②③④
C. ①③④
D. ①②③④
8. 下列离子方程式中正确的是(A)
A. 向碳酸氢钙溶液中加入过量氢氧化钠

 Ca2++2HCO
Ca2++2HCO +2OH- CaCO3↓+2H2O+CO
+2OH- CaCO3↓+2H2O+CO

 B. 氧化铁可溶于氢碘酸:Fe2O3+6H+ 2Fe3++3H2O
B. 氧化铁可溶于氢碘酸:Fe2O3+6H+ 2Fe3++3H2O
 C. Fe3+的检验:Fe3++3SCN- Fe(SCN)3↓
C. Fe3+的检验:Fe3++3SCN- Fe(SCN)3↓
D. Na2S溶液呈碱性:S2一+H2O HS-+OH-
7. 室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
|
|
① |
② |
③ |
④ |
|
pH |
12 |
12 |
2 |
2 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A. 在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B. 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C. 把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH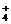 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D. 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
6.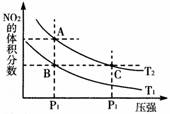 反应N2O4(g)
反应N2O4(g) 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
5. 将40℃的饱和澄清石灰水冷却至10℃或向其中加入少量CaO(但温度仍保持40℃),在这两种情况下均未改变的是(C)
A. Ca(OH)2的溶解度
B. 溶液的质量
C. 溶液中溶质的质量分数
D. 溶液中Ca2+的数目

4. 右图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是(B)
A. b、c、e三种元素的原子半径大小关系:e>c>b
B. 六种元素分别形成的单质晶体中,d的熔、沸点最高
C. c的氢化物沸点比f的氢化物沸点低
D. b元素除0价外,只有一种化合价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com