
23. (8分)将KOH和Ca(OH)2的混合物1.3 g全部溶于一定量水中形成稀溶液,再缓慢通入足量的CO2气体(气体的体积均为标准状况下的体积)。
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积为224 mL。则生成沉淀的最大质量是 1 g;沉淀恰好全部溶解时消耗CO2的体积为 672 mL。
(2)若KOH和Ca(OH)2以任意比混合,总质量仍保持1.3 g不变,通入CO2气体至无沉淀时,最多则消耗CO2的总体积V(mL)的取值范围为 520~787 。
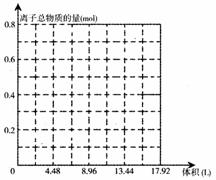
(3)若某溶液中有0.2 mol KOH和0.1 mol Ca(OH)2,往溶液中持续通入CO2,当CO2刚足量时(沉淀恰好全部溶解时),立即改通NH3,作出通入气体总体积与溶液中离子总物质的量的图像。(不考虑气体在水中的溶解度,离子水解和水的电离均忽略不计)
答:见右图
22. (8分)向体积为2 L的固定容积密闭容器中通入3 mo1X气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为 0.03 mol/(L·min)。
(2)若向达到(1)的平衡体系中充入氦气,则平衡向 不 (填“左”或“右”或“不”)移动。
(3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 molX气体,则平衡后X的转化率 小于 (1)的平衡中X的转化率(填“大于”或“等于”或“小于”)
(4)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 0.9<c<4.5 。
21. (6分)(1)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体积是相同状况下该烃蒸气体积的8.5倍,由此分析回答:
①该烃分子中共用电子对数共有 3n-1 对,其中碳原子之间的共用电子对数为n+1。
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式

为 (填任一种)。
(2)有机物A由于其特殊的结构,一直受到理论化学家的注意,由于缺乏有效的合成途径,一度延缓对它的研究,直到1993年出现了可以大量制备的方法,才得以被重视。A是非极性分子,化学式是C6H8,分子的核磁共振氢谱图显示只有一个吸收峰(氢原子只有一种连接方试)。

①A的结构简式为 ;A分子中在同一平面上的碳原子数为 6 。
②A的二氯取代产物的异构体有 4 种。
20. (8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度 (mol·L-1) |
NaOH物质的量浓度 (mol·L-1) |
混合溶液的pH |
|
① |
0.1 |
0.1 |
pH=9 |
|
② |
c |
0.2 |
pH=7 |
|
③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸 HA是弱酸 。
 (2)②组情况表明,c 大于 0.2(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是 c(A-) c(Na+) 。
(2)②组情况表明,c 大于 0.2(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是 c(A-) c(Na+) 。
(3)从③组实验结果分析,说明HX的电离程度 大于 NaX的水解程度(选填“大于”、“小于”或“等于”),
该混合溶液中离子浓度由大到小的顺序是 c(A-)>c(Na+)>c(H+)>c(OH-) 。
(4)①组实验所得混合溶液中由水电离出的c(OH-)= 10-5 mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算:)。
c(Na+)-c(A-)= 10-5-10-9 mol·L-1;
c(OH-)一c(HA)= 10-9 mol·L-1。
19. (8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
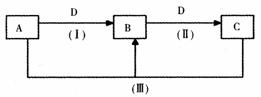
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为 FeCl3或Fe(NO3)3 。(只写一种)
(2)A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ)的化学方程式为4NH3+6NO

 5N2+6H2O 。
5N2+6H2O 。
 (3)D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是 Al3++3A1O
+6H2O
(3)D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是 Al3++3A1O
+6H2O
4A1(OH)3↓
(4)D为酸或酸性气体,则A、B、C、D可以是 NaOH、Na2CO3、NaHCO3、CO2(或NaOH、Na2SO3、NaHSO3、SO2) (请按顺序写出合理任意一组物质的化学式即可)。
18. (6分)下图是一个化学过程的示意图。已知甲池的总反应式为:
 2CH3OH+3O2+4KOH 2K2CO3+6H2O
2CH3OH+3O2+4KOH 2K2CO3+6H2O
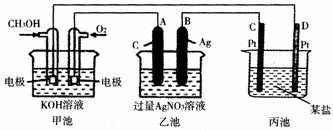
(1)请回答图中:甲电池是 原电池(化学能转变为电能) 装置,
(2)请回答下列电极的名称:A(石墨)电极的名称是 阳极 。
(3)写出通入CH3OH的电极的电极反应式是


 CH3OH+8OH--6e- CO +6H2O 。
CH3OH+8OH--6e- CO +6H2O 。
(4)乙池中反应的化学方程式为 4AgNO3+2H2O 4Ag+O2↑+4HNO3 。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2 280 mL(标准状况下);此时丙池某电池析出0.60 g某金属,则丙中的某盐溶液可能是 B、D (填序号)
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
17. (8分)某同学为了测定三聚氰胺的分子式和结构简式,设计了如下实验:


 查阅资料:三聚氰胺的相对分子质量为126,三聚氰胺在常温下呈晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。取12.6 g的三聚氰胺晶体按如图装置进行实验(假设三聚氰胺完全反应转化成产物)。
查阅资料:三聚氰胺的相对分子质量为126,三聚氰胺在常温下呈晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。取12.6 g的三聚氰胺晶体按如图装置进行实验(假设三聚氰胺完全反应转化成产物)。
 (1)写出A装置中发生反应的化学方程式:2Na2O2+2H2O 4NaOH+O2↑或2H2O2
(1)写出A装置中发生反应的化学方程式:2Na2O2+2H2O 4NaOH+O2↑或2H2O2

2H2O+O2↑(一个即可)。
(2)D装置能不能与E装置互换? 不能 (填“能”或“不能”)。
(3)当B装置中反应完全发生后,读取G中水的体积的实验操作顺序为 ②③① 。(填序号)
①读数 ②冷却至室温 ③调平F、G装置中的液面
(4)测定数据如下:
|
装置 |
D |
E |
|
实验前 |
101.0 g |
56.0 g |
|
实验后 |
106.4
g |
69.2 g |
经测定,F中收集的气体折合标准状况下的体积为6.72 L。
①利用上述实验数据,计算三聚氰胺的实验式为 CN2H2 。
②三聚氰胺的分子式为 C3N6H6 。
③若C装置选用下列材料代替铜网,可选用 C (填序号)
A. CuO B. Mg C. Ag D. C
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N-C≡N,三聚氰胺分子中每个原子最外层电子数均达到8电子或2电子结构,试写出其结构简式:

。
(6)三聚氰胺分子中所有原子 否 (填是、否)共平面
16. 在隔绝空气的情况下,9.8 g Fe、Mg混合物溶于一定量某浓度的稀硝酸中,当金属完全溶解后,收集到0.2 mo1 NO气体,在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为(B)
A. 18 g
B. 20 g C.
22 g D.
24 g

答 题 卡




第Ⅱ卷 非选择题(共52分)

15. 干燥剂的干燥性能可用干燥效率(1 m3空气中实际残留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
|
物质 |
MgO |
CaO |
ZnCl2 |
ZnBr2 |
|
干燥效率g/m3 |
0.008 |
0.2 |
0.8 |
1.1 |
分析以上数据,下列有关叙述不正确的是(D)
A. MgO的干燥性能比CaO好
B. 干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C. MgCl2可能是比CaCl2更好的干燥剂
D. 上述干燥剂中阳离子对干燥性能的影响比阴离子小
14. 某白色固体可能由①NH4Cl、②AlCl3、③NaCl、④AgNO3、⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向该溶液中加稀硝酸到过量,有白色沉淀产生。则对原固体的判断不正确的是(B)
A. 肯定存在①
B. 至少存在②和⑤
C. 无法确定是否有③
D. 至少存在①、④、⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com