
3.
 某温度,反应SO2(g)+
某温度,反应SO2(g)+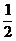 O2(g) SO3(g)的平衡常数K=50,在同一温度下,反应2SO3(g)
2SO2(g)+O2(g) 的平衡常数K值应为( )
O2(g) SO3(g)的平衡常数K=50,在同一温度下,反应2SO3(g)
2SO2(g)+O2(g) 的平衡常数K值应为( )
A. 2500 B. 100 C.4×10-4 D. 2×10-2
2. 对于3Fe(s)
+ 4H2O(g)
Fe3O4(s) + 4H2(g)反应的化学平衡常数的表达式为( )
对于3Fe(s)
+ 4H2O(g)
Fe3O4(s) + 4H2(g)反应的化学平衡常数的表达式为( )
A.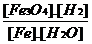 B.
B. 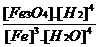 C.
C.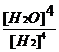 D.
D.
1.下列关于平衡常数K的说法中,正确的是( )
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小可以推断一个反应进行的程度
2.例题解析
 例1.密闭容器中进行如下反应: X2(g)
+ 3Y2(g) 2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L-1 、 0.6mol.L-1 、0.4mol.L-1 ,当平衡时,下列数据肯定不对的是( )
例1.密闭容器中进行如下反应: X2(g)
+ 3Y2(g) 2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L-1 、 0.6mol.L-1 、0.4mol.L-1 ,当平衡时,下列数据肯定不对的是( )
A. X2为0.4mol.L-1,Y2为1.2mol.L-1 B. Y2为1.0mol.L-1
C. X2为0.3mol.L-1,Z为0.2mol.L-1 D. Z为1.0mol.L-1
分析 :若X2、Y2完全反应,则可生成Z的浓度为0.8mol.L-1,若Z完全转化为X2、Y2,则X2、Y2最多可达0.4mol.L-1、1.2mol.L-1,但反应为可逆反应,故不能进行到底。
答案:A、D
点评:化学平衡研究的是可逆反应,故解这类题目要善于利用极值法。另外,选项中将所有物质的浓度都列出来,还得注意物质的量是否守恒。
 例2.HI分解反应为2HI(g) H2(g) + I2(g),若开始时有1 mol
HI,平衡时有24.4 %的HI发生了分解。今欲将HI的分解率降到10 %,应往此平衡体系中加入I2 物质的量是多少?
例2.HI分解反应为2HI(g) H2(g) + I2(g),若开始时有1 mol
HI,平衡时有24.4 %的HI发生了分解。今欲将HI的分解率降到10 %,应往此平衡体系中加入I2 物质的量是多少?
解析:设容器的体积为V,应向平衡体系中加入I2 物质的量为x
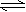 2HI(g) H2(g) + I2(g)
2HI(g) H2(g) + I2(g)
起始浓度mol.L-1 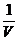 0
0
0
0
原平衡浓度mol.L-1 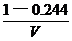
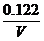
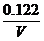
新平衡浓度mol.L-1 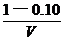
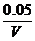
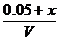
根据题意,温度不变,则平衡常数不变:
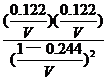 ==
== 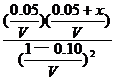
答案:x = 0.372 mol
 例3.反应NH4HS(s) NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是( )
例3.反应NH4HS(s) NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是( )
A.温度、容积不变时,通入SO2气体 B.加入一部分NH4HS固体
C.保持容器体积不变,充入氮气 D.保持容器体积不变,通入氯气
 解析:在NH4HS(s) NH3(g)+H2S(g)的平衡体系中,当恒温、恒容通入SO2时,SO2与H2S反应,将使的浓度减小;因NH4HS为固体,增加或减少其量,浓度不变;容积不变,充入氮气,体系的总压强虽然增大,但NH3和H2S的浓度却没改变;压强不变,充入氮气,相当于将容器中的NH3、H2S稀释。
解析:在NH4HS(s) NH3(g)+H2S(g)的平衡体系中,当恒温、恒容通入SO2时,SO2与H2S反应,将使的浓度减小;因NH4HS为固体,增加或减少其量,浓度不变;容积不变,充入氮气,体系的总压强虽然增大,但NH3和H2S的浓度却没改变;压强不变,充入氮气,相当于将容器中的NH3、H2S稀释。
答案:B、C
 例4.对反应2NO2(g) N2O4(g),在一定条件下达到平衡,在温度不变时,欲使[NO2] / [N2O4]的比值增大,可采取的方法是( )
例4.对反应2NO2(g) N2O4(g),在一定条件下达到平衡,在温度不变时,欲使[NO2] / [N2O4]的比值增大,可采取的方法是( )
A.使体积增大到原来的2倍 B.体积不变,增加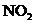 的物质的量
的物质的量
C.保持压强不变
,充入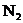 D.体积不变,增加
D.体积不变,增加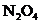 的物质的量
的物质的量
解析:A. 扩大体积,容器内的压强减小,平衡向气体体积增大方向移动,即平衡左移,[NO2]增大,[N2O4]减小,[NO2] / [N2O4]变大;B. 根据[N2O4] / [NO2]2=K,可化为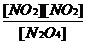 =
=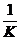 ,据此分析,体积不变,增加n(NO2),即增加了C(NO2),所以[NO2] / [N2O4]变小;同理,D体积不变,增加n(N2O4),C(N2O4)变大,平衡左移,结果[NO2]也变大,据上式分析得[NO2] / [N2O4]变小;C压强不变,充入N2,容器体积必然扩大,平衡左移,[NO2] 增大,[N2O4] 减小,[NO2] / [N2O4]变大。
,据此分析,体积不变,增加n(NO2),即增加了C(NO2),所以[NO2] / [N2O4]变小;同理,D体积不变,增加n(N2O4),C(N2O4)变大,平衡左移,结果[NO2]也变大,据上式分析得[NO2] / [N2O4]变小;C压强不变,充入N2,容器体积必然扩大,平衡左移,[NO2] 增大,[N2O4] 减小,[NO2] / [N2O4]变大。
答案:A、C
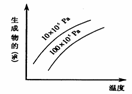 例5.由可逆反应测绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
例5.由可逆反应测绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
A. 反应物中一定有气体 B. 生成物中一定有气体
C. 正反应一定是放热反应 D. 正反应一定是吸热反应
解析: 定一议二。温度不变时,增大压强,生成物的百分含量降低,说明平衡逆向移动,逆向为体积缩小方向,而题中未给出具体的可逆反应,但是可以确定生成物中一定有气体;压强不变时,升高温度,生成物的百分含量增大,说明平衡正向移动,正向为吸热反应。
答案:B、D
 例6 在容积相同且固定不变的四个密闭容器中,进行同样的可逆反应:2A(g) + 3B(g) 3C(g) + 2D(g),
例6 在容积相同且固定不变的四个密闭容器中,进行同样的可逆反应:2A(g) + 3B(g) 3C(g) + 2D(g),
起始时四个容器所盛A、B的量分别是 甲:A 2mol,B 1mol;乙:A 1mol,B 1mol;丙:A 2mol,B 2mol;丁:A 1mol,B 2mol,在相同温度下建立平衡时,A或B的转化率大小关系正确的是( )
A. B的转化率:甲<丙=乙<丁 B. A的转化率:甲<丙<乙<丁
C. B的转化率:甲>丙>乙>丁 D. A的转化率:甲<乙<丙<丁



 解析:甲、乙、丙、丁四个容器的容积相同在同温时放入A、B的物质的量不同,对于可逆反应2A(g) + B(g) 3C(g) + 2D(g),加压时,向逆反应方向移动;减压时向正反应方向移动。我们将甲、乙、丙、丁四个容器中的变化用下列框图表示分析比较。则B的转化率:甲>乙>丙>丁,A的转化率:丁>乙>丙>甲
解析:甲、乙、丙、丁四个容器的容积相同在同温时放入A、B的物质的量不同,对于可逆反应2A(g) + B(g) 3C(g) + 2D(g),加压时,向逆反应方向移动;减压时向正反应方向移动。我们将甲、乙、丙、丁四个容器中的变化用下列框图表示分析比较。则B的转化率:甲>乙>丙>丁,A的转化率:丁>乙>丙>甲
答案:B

|
基础训练
1.方法导引
(1)有关化学平衡的计算,浓度、压强、温度对化学平衡的影响规律是本节的重点。
(2)对于一个已知的化学反应,当温度一定时,化学平衡常数K为确定的值。温度对平衡移动的影响是通过改变平衡常数实现的。浓度、压强的影响是通过使Qc与Kc不再相等,而使平衡发生移动。
(3)浓度适用于有气体参加或气体生成的反应或溶液中进行的反应,所以通常认为改变固体的量时化学平衡不发生移动。
(4)反应物有两种或两种以上,增加一种物质的浓度,该物质的平衡转化率降低,而其他物质的转化率升高。
(5)不特别指明时,增大压强均指压缩体积。平衡混合物是固体或溶液时,改变压强,平衡不移动。改变体系的压强相当于改变体系的体积,也就相当于改变物质的浓度(如增大体系的压强相当于增大气体的浓度),压强对化学平衡移动的影响是由于压强改变引起气体浓度的改变而引起化学平衡移动的,若压强的改变并没有造成气体浓度的改变则平衡不移动。稀有气体(或不参加反应的气体)的加入而导致的压强变化,对化学平衡的影响,要具体分析平衡物质的浓度是否变化,即体系占据的体积是否改变。恒容时,压强增大,但体积不变,所以浓度不变,平衡不移动。恒压时,体积增大,反应物和生成物的浓度同时减小,相当于减小压强,平衡向总体积增大的方向移动。
(6)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
4. 反应条件对化学平衡的影响
在其他条件不变的情况下,
(1)改变温度:升高反应体系的温度,平衡向________的方向移动;
降低反应体系的温度,平衡向________的方向移动。
温度对平衡移动的影响是通过改变_______________实现的。
(2)改变浓度:增大反应物的浓度或减小生成物的浓度,Qc ___Kc,化学平衡____移动。
增大生成物的浓度或减小反应物的浓度,Qc ___Kc,化学平衡____移动。
(3)改变压强:增大体系压强,平衡向着气体体积_________的方向移动;
减小体系压强,平衡向着气体体积_________的方向移动。
※勒夏特列原理--平衡移动原理
 2SO2(g)+
O2(g) 2SO3(g);ΔH>0,设平衡状态下,体系中O2的物质的量浓度为a mol·L-1,SO3的物质的量浓度为bmol·L-1,气体的压强为M Pa ,气体的温度为d ℃。
2SO2(g)+
O2(g) 2SO3(g);ΔH>0,设平衡状态下,体系中O2的物质的量浓度为a mol·L-1,SO3的物质的量浓度为bmol·L-1,气体的压强为M Pa ,气体的温度为d ℃。
(1)将平衡体系中的C(O2)增大为2a mol·L-1,则平衡将向____反应方向移动,使O2物质的量浓度______,达到新平衡时[O2]与2a mol·L-1、a mol·L-1比较为__________________。
(2)将平衡体系中的C(SO3)减小为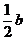 mol·L-1,则平衡将向____反应方向移动,使SO3物质的量浓度______,达到新平衡时[O2]与b mol·L-1、
mol·L-1,则平衡将向____反应方向移动,使SO3物质的量浓度______,达到新平衡时[O2]与b mol·L-1、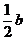 mol·L-1比较为__________________。
mol·L-1比较为__________________。
(3)将体系气体温度一次性升高到2d ℃,则平衡向_____反应方向移动,使体系的温度______,达到新平衡时,温度t与d ℃、2d ℃比较为________________________。
(4)将体系气体压强一次性降到 Pa,则平衡向_____反应方向移动,使体系的压强______,达到新平衡时,压强p与
Pa,则平衡向_____反应方向移动,使体系的压强______,达到新平衡时,压强p与 Pa、M Pa比较为_______________________。
Pa、M Pa比较为_______________________。
学习导航
3. 化学平衡的计算
(1) 可逆反应达到平衡过程中物质浓度的变化关系
反应物:平衡浓度 = ______________________;
生成物:平衡浓度 = ______________________。
各物质的转化浓度之比等于_________________之比。
(2)平衡转化率
 对于化学反应 aA + bB c C + d D 反应物A的转化率α(A)=_________________
对于化学反应 aA + bB c C + d D 反应物A的转化率α(A)=_________________
① 温度一定,反应物的转化率因反应物的不同而不同。
② 提高A在原料气中的比例,可使B的转化率________,而A的转化率_________。
提高B在原料气中的比例,可使A的转化率________,而B的转化率_________。
(3)平衡时某组分的百分含量 A%=____________________
2. 用化学平衡常数判断反应进行的方向
 对于化学反应 aA + bB c C
+ d D,浓度商Qc =_______________
对于化学反应 aA + bB c C
+ d D,浓度商Qc =_______________
当 Qc =Kc时,反应________________;
Qc>Kc时,反应________________;
Qc<Kc时,反应________________。
1. 化学平衡常数K及表达式
化学平衡常数可定量描述化学反应的限度。
在______一定时,对于确定的反应,K为常数,压强、浓度的改变与平衡常数______(无关,有关)。K值越大,反应进行的越________。
 aA
+ bB c C + d D , Kc =______________________
aA
+ bB c C + d D , Kc =______________________
 (1)对于有纯固体或纯液体参加的反应,如:CaCO3(s) CaO(s)+CO2(g), Kc =_______
(1)对于有纯固体或纯液体参加的反应,如:CaCO3(s) CaO(s)+CO2(g), Kc =_______
C(B)表示____________ C0(B)表示____________ [B] 表示____________
(2)若A、B、C、D均为气体,Kp =________________
※气体分压定律:
混合气体中某组分气体_____________所表现的压强为该气体的分压强,简称分压。
总压强为混合气体各组分分压________。
混合气体中,分压之比与气体物质的量有何关系?当体积一定时,与浓度又有何关系?
__________________________________________________________________________
 浓度平衡常数(Kc):由各物质_________算得的平衡常数。
浓度平衡常数(Kc):由各物质_________算得的平衡常数。
(3)化学平衡常数
压强平衡常数(Kp):由各物质_________算得的平衡常数。
(4)可逆反应的化学平衡常数表达式与方程式的书写有关。
 3H2(g) + N2(g) 2NH3(g) K1= __________
3H2(g) + N2(g) 2NH3(g) K1= __________

 H2(g) +
H2(g) +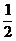 N2(g) NH3(g) K2=__________
N2(g) NH3(g) K2=__________
 2NH3(g) 3H2(g) + N2(g) K3=___________
2NH3(g) 3H2(g) + N2(g) K3=___________
K1 ,K2,K3之间的关系_____________________
4. 掌握浓度、压强、温度对化学平衡的影响规律,会判断化学平衡移动的方向。
知识梳理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com