
4.下列几种说法中正确的是
A.摩尔是化学上常用的一个物理量
B.某物质含有6.02×1023个粒子,含有这个数目粒子的物质一定是1mol
C.1摩尔氢气分子可以表示为1molH2
D.硫酸的摩尔质量为98g
3.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
2.在人体所需的十多种微量元素中,有一种被称为“生命元素”的R,它对延长人类生命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物的化学式为RO3,则R元素是
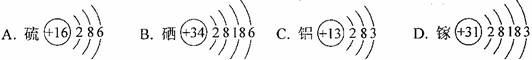
1.化学与生活、环境有着密切的关系,下列做法中正确的是
A.用三聚氰胺作食品(饲料)添加剂,以提高食品检测中的蛋白质含量指标
B.将废弃的电子产品(电子垃圾)掩埋地下或焚烧处理,以免有害物质污染环境
C.提倡购物时少用塑料袋或不用塑料袋,以减少“白色污染”
D.在腊肉、香肠中加入大量的亚硝酸钠(NaNO2),以防腐、增色。
22.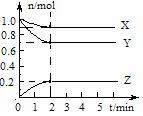 某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请根据图示数据。
某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请根据图示数据。
⑴计算反应开始2min内,Y的平均反应速率。
⑵写出X、Y、Z的反应方程式。
(1) 解:设Y的平均反应速率为vY
vY=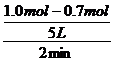 =0.03 mol/(L·min)
=0.03 mol/(L·min)
答:开始2min内,Y的平均反应速率为0.03 mol/(L·min)
(2) X+3Y=2Z.
20.(6分)全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
⑴空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:① (写出离子方程式);②Br2+3CO32-=BrO3-+ 5Br-+3CO2↑;③BrO3-+ 5Br-+6H+=-3Br2+3H2O。
⑵空气吹出SO2吸收法。该方法基本同⑴,只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴水与二氧化硫反应的离子反应方程式:
。
⑶溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
(1)Cl2+2Br-=2Cl-+Br2 ;(2)Br2+SO2+2H2O=2HBr+H2SO4;(3) ②。
21.(12分)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。
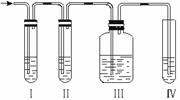
⑴Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ_______;Ⅱ______;Ⅲ_______;Ⅳ_____(将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH(aq)
C.浓H2SO4 D.酸性KMnO4(aq)
⑵能说明二氧化硫气体存在的现象是_______________________________。
⑶使用装置Ⅱ的目的是___________________________________________。
⑷使用装置Ⅲ的目的是___________________________________________。
⑸确证含有乙烯的现象是_________________________________________。(1)A B A D (2)装置I中品红溶液褪色 (3)除去二氧化硫气体,以免干扰乙烯的实验;检验二氧化硫是否除尽 (4)装置III中的品红溶液不褪色,装置IV的酸性高锰酸钾溶液褪色
19.(6分)糖类、油脂、蛋白质都是人体必需的营养物质。
⑴氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和____________(写名称);通常情况下,蛋白质遇浓硝酸呈 色。
⑵淀粉在淀粉酶的作用下最终水解为葡萄糖,淀粉的特征反应为遇 (写化学式)显蓝色;
(1)羧基 黄(2)I2
18.(8分)A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
⑴写出D在周期表中的位置 ;
⑵写出B、F两元素形成化合物的电子式: ;
⑶A.C两元素的化合物与B的氢氧化物反应的离子方程式为 ;
⑷D气态氢化物的稳定性 (填“大于”、“小于”)E的气态氢化物的稳定性。
⑴ 第二周期 ⅣA ⑵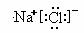
⑶ Al2O3+2OH-=2AlO2-+H2O
⑷ 小于
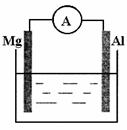
17.(8分)如右下图所示装置:
⑴若烧杯中溶液为稀硫酸,则观察到的现象为 。
正极反应式为: ;
⑵若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
(1)镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
2H++2e-=H2↑
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
16.(8分)有效地利用现有能源和开发新能源已受到各国的普遍重视。
⑴可用改进汽油组成的办法来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。 CH3OC(CH3)。分子中必存在的原子间连接形式有 (填写编号)
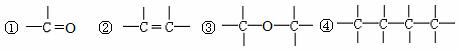
⑵天然气的燃烧产物无毒、热值高,而且管道输送方便,将成为我国西部开发的重点项目之一。天然气常和石油伴生,其主要的成分是甲烷。能说明它是正四面体而非正方形平面结构的理由是 (填写编号)。
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体 ③它是含有极性键的分子 ④它的键长和键角都相等
⑶1980年我国首次制得一辆燃烧氢气的汽车,乘员12人,以50 km/h行驶了40km。为了有效开展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济的制氢方法是 (填写编号)。
①电解水 ②锌和稀硫酸反应 ③光解海水
 其次,制得纯氢气后还需要解决的问题是
(写出其中一个)
其次,制得纯氢气后还需要解决的问题是
(写出其中一个)
(1)③(2)甲烷②(3)③氢气的输送和贮存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com