
1.钠的物理性质
钠是 色有 的 体,硬度较 , 低,密度比水 。
钠元素位于周期表__周期__族,自然界中钠只能以 的形态存在,主要以
的形式存在。
16.A、B、C、D是同一周期的四种元素。A、B、C的原子序数依次相差1。A元素的单质的化学性质活泼,A元素的原子在本周期中原子半径最大,B元素的氧化物2.0g恰好跟100mL0.50mol/L硫酸完全反应,B元素单质跟D元素单质反应生成化合物BD2。根据以上事实填写下列空白:
(1) A的原子结构示意图___________;C原子的外围电子排布式____________
BD2的电子式_______________。
(2) 用元素符号或离子符号表示:
四种元素原子第一电离能的大小顺序为______ _____________________;
四种元素原子半径的大小顺序为____________ ___ ________________;
四种元素形成简单离子的离子半径大小顺序为_____ _________________。
14.A、B两元素在周期表中位于同一周期,核电荷数均小于36,最外层均为一个电子,A的次外层为8个电子,B的电子排布式为 [Ar] 3d 104s1,则A的元素符号为_______,位于周期表第_______周期,_______族,价电子排布式为_________;B的元素符号为_______,位于周期表第_______周期,_______族。
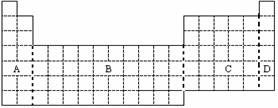 15.右图是元素周期表:
15.右图是元素周期表:
(1)在上面元素周期表中全部是金
属元素的区域为 。
(2)在上面元素周期表中画出金属
元素与非金属元素的分界线。
(3)根据NaH的存在,有人提议可
把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(4)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,
请你根据学过的化学知识判断这一元素是 。
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 ______(填名称),
可以验证该结论的实验是 ______ 。
(a) 将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b) 将这两种元素的单质粉末分别和同浓度的盐酸反应
(c) 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d) 比较这两种元素的气态氢化物的稳定性
13.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是:
A.K、Na 、Li B.Al、Mg 、Na C.N、O、C D.Cl、S、P
12.原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实不能作为这个规则的证据的是:
A.元素硼(B)的第一电离能小于元素铍(Be)的第一电离能
B.元素磷(P)的第一电离能大于元素硫(S)的第一电离能
C.基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
D.某种激发态碳(C)原子排布式为1s22s12p3而不是1s22s22p2
11.下列说法正确的是:
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的的第一电离能大
10.下列微粒半径的比较中,正确的是:
A.Na+ > Na B.Cl-> Cl C.Ca 2+ > Cl- D.Mg >Na
9.下列说法中错误的是:
A.所有的非金属元素都分布在p区
B.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦以外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质,化学性质均相同
8.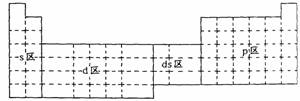 下面元素周期表中
下面元素周期表中
全部是金属元素的
区域为:
A.只有s区
B.只有d区
C.s区、d区和ds区
D.d区和ds区
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com