
10.(16分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
 反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
 请回答下列问题:
请回答下列问题:
 (1)通常实验室制取CO2气体的离子方程式是
,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是
(填写“I”、“II”或“III”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是
溶液,装置C中应盛放的试剂是
。
(1)通常实验室制取CO2气体的离子方程式是
,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是
(填写“I”、“II”或“III”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是
溶液,装置C中应盛放的试剂是
。
(2)观察实验装置图可知Na与CO2反应的条件是 ,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是 ,待装置 (填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
|
9.(1)Al (2分)
(2) ①浓H2SO4 C+2H2SO4==CO2+2SO2+2H2O (3分)
②浓HNO3 ;CO2 NO (3分)
(3) Fe3+ Cu2+ H+ (2分)
(4) 2Fe2+ + 4I- + 3H2O2 == 2I2 + 2Fe(OH)3 (2分)
(5) CuO C 或 CuO, C,Fe2O3 (2分)
9.由Fe2O3、Fe、CuO、C、Al中的两种或两种以上物质组成的混合粉末,取样进行下列实验(部分产物略去):

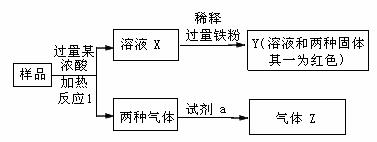
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中肯定不含有的物质是(填化学式)________________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中用到的浓酸是_____(填化学式),能同时生成两种气体的化学方程式是___________________________。
 ②若Z为两种气体的混合物,试剂a为适量的水,则反应Ⅰ中用到的浓酸是_________(填化学式),Z中两种气体的化学式是________________。
②若Z为两种气体的混合物,试剂a为适量的水,则反应Ⅰ中用到的浓酸是_________(填化学式),Z中两种气体的化学式是________________。
(3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)______________ _______________________________________________。
(4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是___________________________________________。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)___________________ ____________________。
8.(1)F的晶体类型:离子晶体
(2)反应①的化学方程式
(3)B、E反应的离子方程式:
(4)化学方程式:
或 或
或
8. 两种元素形成的化合物A 它广泛应用于大规模集成电路生产领域。可按图示进行反应。已知G、H为单质,C、H为气体,电解熔融的F是工业上制备G的重要方法。A、B、D、E、F中均含G元素,且G元素在A中占65.9%,反应中部分产物已略去。
两种元素形成的化合物A 它广泛应用于大规模集成电路生产领域。可按图示进行反应。已知G、H为单质,C、H为气体,电解熔融的F是工业上制备G的重要方法。A、B、D、E、F中均含G元素,且G元素在A中占65.9%,反应中部分产物已略去。

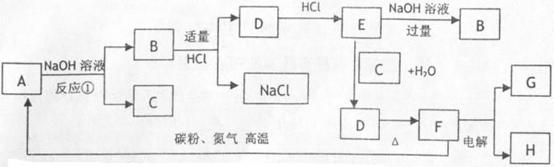
 (1)F的晶体类型为___________。
(1)F的晶体类型为___________。
 (2)写出反应①的化学方程式:________________________________。
(2)写出反应①的化学方程式:________________________________。
 (3)若把B溶液与E溶液混合反应的离子方程式是:______________________。
(3)若把B溶液与E溶液混合反应的离子方程式是:______________________。
 (4)用化学防护曾市表示单质G在工业上的一种应用:_______________________
(4)用化学防护曾市表示单质G在工业上的一种应用:_______________________
7. 一定温度下,1 molX和n molY在容积为2 L的密闭容器中发生如下反应:
一定温度下,1 molX和n molY在容积为2 L的密闭容器中发生如下反应:
 X(g)+Y(g)
X(g)+Y(g)  Z(g)+M(s),5 min后达到平衡,此时生成a molZ。下列说法正确的是D
Z(g)+M(s),5 min后达到平衡,此时生成a molZ。下列说法正确的是D
 A.向平衡后的体系中加入1 molM,平衡向逆反应方向移动
A.向平衡后的体系中加入1 molM,平衡向逆反应方向移动
 B.用X表示此反应的反应速率是(0.1-0.1a)
mol•(L•min)-1
B.用X表示此反应的反应速率是(0.1-0.1a)
mol•(L•min)-1
 C.向上述平衡体系中再充入1 molX,U (正)增大,U (逆)减小,平衡正向移动
C.向上述平衡体系中再充入1 molX,U (正)增大,U (逆)减小,平衡正向移动
 D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态








6. 常温下,关于下列溶液的叙述错误的是 ( D )
常温下,关于下列溶液的叙述错误的是 ( D )

 A.pH=3的弱酸溶液和pH
=11的强碱溶液等体积混合后溶液呈酸性
A.pH=3的弱酸溶液和pH
=11的强碱溶液等体积混合后溶液呈酸性
 B.pH =5的硫酸溶液稀释到原来的500倍,稀释后溶液中c(SO42-)与c(H+)之比约为1:10
B.pH =5的硫酸溶液稀释到原来的500倍,稀释后溶液中c(SO42-)与c(H+)之比约为1:10
 C.向1L0.3mol/L的NaOH溶液缓缓通入CO2气体至溶液增重8.8g,则溶液中
C.向1L0.3mol/L的NaOH溶液缓缓通入CO2气体至溶液增重8.8g,则溶液中
 2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
 D.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则
D.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则
 C[(NH4)2SO4]
> c[(NH4)2CO3] > c[(NH4)2Fe(SO4)2]
C[(NH4)2SO4]
> c[(NH4)2CO3] > c[(NH4)2Fe(SO4)2]
5.
 下列肯定能达到目的的是 ( D )
下列肯定能达到目的的是 ( D )

 ①用一种试剂就能鉴别下列七瓶无色溶液:
①用一种试剂就能鉴别下列七瓶无色溶液:





 ②不用任何其他试剂可以鉴别下列四瓶无色溶液:
②不用任何其他试剂可以鉴别下列四瓶无色溶液:


|
 A.只有①能达到目的 B.只有②能达到目的
A.只有①能达到目的 B.只有②能达到目的
 C.①②都达不到目的 D.①②都能达到目的
C.①②都达不到目的 D.①②都能达到目的
4.由部分短周期元素形成的单质或氧化物之间有以下关系:
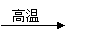
单质(X)+氧化物(M) 氧化物(N)

单质(Y)+氧化物(M) 单质(X)+氧化物(R)

单质(X)+氧化物(Z) 氧化物(N)
若X为非金属单质,则组成Y单质的元素在周期表中的位置是 ( C )
A.第二周期IVA族 B.第二周期VIA族
C.第三周期IIA族 D.第三周期IVA族
3.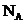 代表阿伏加德罗常数,下列叙述错误的是D
代表阿伏加德罗常数,下列叙述错误的是D
 A.标况下,
A.标况下,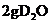 含质子数为
含质子数为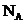
 B.
B. 只来年感分数为98%的
只来年感分数为98%的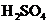 ,用水稀释至
,用水稀释至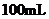 ,
,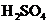 的质量分数大于9.8%
的质量分数大于9.8%
 C.等温等压下,
C.等温等压下,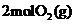 和
和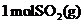 的密度不同
的密度不同
 D.锌与硫酸反应,放出
D.锌与硫酸反应,放出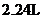 气体时,转移电子数为
气体时,转移电子数为 个
个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com