
12. (12分)2008年9月25日,“神舟七号”发射成功,标志着我国
(12分)2008年9月25日,“神舟七号”发射成功,标志着我国
的航天事业进入一个崭新的时期.
(1)“神舟七号”所用火箭推进剂由液态肼(N2H4)和液态双氧水组
成,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量
热.
已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65 kJ的热量.
①反应的热化学方程式为:____________________________________________.
②反应中的氧化剂是:________(写化学式).
③当有1 mol氮气生成时,反应转移的电子数为______NA.
④此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________________________________________________.
(2)我国“长征三号甲”运载火箭一级推进剂采用四氧化二氮和偏二甲肼(C2H8N2)作为推进剂,请写出推进剂在发动机中充分燃烧时发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________.
该反应中氧化产物与还原产物的物质的量之比为________.
解析:(1)0.4 mol液态肼反应时放出256.65 kJ的热量,1 mol液态肼反应时放出的热量为:×1 mol=641.63 kJ,从而可写出热化学方程式.
(2)化学方程式为2N2O4+C2H8N2点燃3N2+2CO2+4H2O,C2H8N2中碳元素为-2价,氮元素为-2价 ,若1 mol偏二甲肼完全反应,则生成的氧化产物为2 mol CO2和1 mol N2,还原产物为2 mol N2,则二者物质的量之比为3∶2.
答案:(1)①N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.63 kJ/mol
②H2O2 ③4 ④产物稳定且不污染环境
(2)2N2O4+C2H8N2点燃3N2+2CO2+4H2O 3∶2
11.(8分)在同温同压下,下列各组热化学方程式中Q2>Q1的是________;ΔH2>ΔH1的是________.
A.2H2(g)+O2(g)===2H2O(g) ΔH1=-Q1 kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH2=-Q2 kJ/mol
B.S(g)+O2(g)===SO2(g) ΔH1=-Q1 kJ/mol
S(s)+O2(g)===SO2(g) ΔH2=-Q2 kJ/mol
C.C(s)+O2(g)===CO(g) ΔH1=-Q1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ/mol
D.H2(g)+Cl2(g)===2HCl(g) ΔH1=-Q1 kJ/mol
H2(g)+Cl2(g)===HCl(g) ΔH2=-Q2 kJ/mol
解析:反应热数值的大小与反应物、生成物的种类有关,与反应物物质的量的多少有关,与反应物和生成物的聚集状态有关,还与反应时的外界条件有关.A选项:生成物的状态不同,由于从气态水到液态水会放热,所以生成液态水比生成气态水放出的热多,即Q2>Q1;由于ΔH为负值,所以ΔH2<ΔH1(以下分析相同).B选项:反应物的状态不同,由于从固态硫到气态硫要吸热,所以气态硫燃烧放出的热量比固态硫燃烧放出的热量多,即Q2<Q1;ΔH2>ΔH1.C选项:生成物的种类不同,由于CO与O2反应生成CO2要放出热量,故Q2>Q1;ΔH2<ΔH1.D选项:反应物的物质的量不同,前一反应的物质的量是后一反应的物质的量的2倍,故Q1=2Q2,即Q2<Q1;ΔH2>ΔH1.
答案:AC BD
10.(2009·临沂质检)如图所示是298 K时N2与H2反应过程中
能量变化的曲线图.下列叙述正确的是 ( )
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH
2NH3 ΔH
=-92 kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
解析:热化学方程式中,必须注明各物质的状态,A错误;该反应为可逆反应,反应不能进行彻底,故通入2 mol N2和6 mol H2反应后不可能生成4 mol NH3,放出的热量少于184 kJ,压强越小反应进行的程度越小,即平衡向逆反应方向移动,在同一容器中充入1 mol N2和3 mol H2反应后放出的热量小于前者的一半,D正确;加入催化剂可以降低活化能,使反应速率增大,但不会改变反应热,B、C错误.
答案:D
9.(2009·潍坊质检)已知热化学方程式:2SO2(g)+O2(g)  2SO3(g) ΔH=-Q kJ/mol(Q>0).下列说法正确的是
( )
2SO3(g) ΔH=-Q kJ/mol(Q>0).下列说法正确的是
( )
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化
解析:由于SO2和O2反应放热,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,A错误.SO2和O2的反应是可逆反应,将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,参加反应的SO2小于2 mol,放出的热量小于Q kJ,B错误.增大压强,该平衡向正反应方向移动,C错误.
答案:D

8.已知:H2(g)+F2(g)===2HF(g)
ΔH=-270 kJ/mol,下列说法正确的是 ( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用右图来表示
解析:由热化学方程式可知ΔH<0,H2和F2反应生成HF是放热反应,则HF分解生成H2和F2为吸热反应,A错误.HF(g)转变为HF(l)放热,则1 mol H2与1 mol F2 反应生成2 mol液态HF,放出的热量大于270 kJ,B错误.该反应为放热反应,则反应物的总能量高于生成物的总能量,C正确.该反应中能量变化的图示为
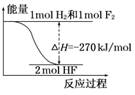
答案:C
7.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量;③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=183 kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=-183 kJ/mol
解析:氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol,所以生成2 mol氯化氢气体,反应的ΔH=-183 kJ/mol.
答案:C

6.从如图所示的某气体反应的能量变化分析,以下判断错误的是 ( )

A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
解析:因反应物的能量高于生成物的能量,故反应放热,且生成物比反应物更稳定,A、C正确,D项不正确;反应是否需要加热与反应吸、放热无必然联系,B项正确.
答案:D
5.(2010·兰州月考)下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
解析:石墨转化为金刚石是吸热反应,金刚石能量高,石墨比金刚石稳定,B不正确;醋酸反应过程中继续电离,电离吸收热量,C不正确;碳完全燃烧生成CO2比不完全燃烧生成CO放出的热量多,但是其反应热ΔH是负值,故ΔH1<ΔH2,D不正确.
答案:A
4.已知:
(1)H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol
(3)H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ/mol
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是 ( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
解析:(1)(2)式反应物、生成物的状态均相同,(1)×2=(2),即2ΔH1=ΔH2,2a=b,因为H2的燃烧反应为放热反应,故2a=b<0,C项符合题意.同理,(3)×2=(4),有2c=d<0,D项错误;由于气态水转变为液态水要放热,有ΔH=-a+c<0,c<a<0,A项错误;同理,ΔH=-b+d<0,d<b<0,B项错误.
答案:C
3.2008年北京奥运会火炬采用了只含碳、氢两种元素的丙烷做燃料,燃烧后只生成CO2和H2O,对环境无污染,体现了绿色奥运的精神.已知1 g丙烷完成燃烧生成CO2气体和液态水,放出50.405 kJ热量,则下列热化学方程式正确的是 ( )
A.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-50.405 kJ/mol
B.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=+2 217.82 kJ/mol
C.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=+50.405 kJ/mol
D.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 217.82 kJ/mol
解析:1 mol丙烷完全燃烧生成CO2气体和液态水,放出热量为44×50.405 kJ=2 217.82 kJ.所以热化学方程式应为:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 217.82 kJ/mol.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com