
1.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AgNO3溶液中逐滴加入过量氨水;
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①④ C.①③ D.②③
17.海水是人类的资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
I、海水淡化历史最悠久、技术最成熟的方法是 。
II、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

(1)步骤①反应的离子方程式是 。
(2)步骤③反应的化学方程式是 。
(3)提取溴单质,采用蒸馏“溴水混合物II”而不是蒸馏“溴水混合物I”,请说明原因
。
III、(1)请写出电解食盐水制取氯气的化学方程式 。
(2)若电解2 L饱和食盐水,通过电路的电子的物质的量为2 mol ,则若用混合均匀后的pH为 ;若用该溶液将阳极产物全部吸收,反应是离子方程式为 ,所得溶液的pH 7(填“>”、“=”、“ <”),理由是 。
(3)已知常温下三种物质电离反应的平衡常数如下:H2CO3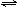 HCO3-+H+ K1=4.45×10-7,HCO3-
HCO3-+H+ K1=4.45×10-7,HCO3-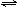 CO32-+H+ K2=5.16×10-11,,HClO
CO32-+H+ K2=5.16×10-11,,HClO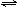 ClO-+ H+ K3=2.95×10-8,请写出氯气和碳酸钠物质的量之比为1∶1时,把氯气通入碳酸钠溶液中反应的离子方程式:
。
ClO-+ H+ K3=2.95×10-8,请写出氯气和碳酸钠物质的量之比为1∶1时,把氯气通入碳酸钠溶液中反应的离子方程式:
。
[答案]1 A
2 D 3 A 4 B
5 A 6D 7 B 8A 9 B 10
B 11C 12C
13:(1)CO2(SO2)、H2S、AlCl3中任选两种(2)Cl2 ;A中R的化合价必介于B、C之间。
14(1)①H-O-H ②2C+SiO2 Si+2CO↑ (各2分)
(2)2Na2O2+2CO2=Na2CO3+O2; 呼吸面具和潜水艇中做为氧气的来源
15 (1)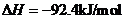
(2)①②
(3) 0.02
0.02
(4)①负极,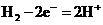 ; 阳极,
; 阳极,
②13
16(1)0.008mol(2分); 268.8(2分);
(2)①A(1分),因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化(2分) ②123547(2分)(注: 1547考虑也给分) ③升高(1分)
(3)有(2分) 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
17 I. 蒸馏法 (1分)
II.(1)2Br-+ Cl2=2Cl-+Br2 (2分) SO2+ Br2 +2H2O=2HBr +2H2SO4 (2分)
(3)“溴水混合物II”实际上是“溴水混合物I”的浓缩结果,蒸馏时生产成本低。(2分)

III. (1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑ (1分)
(2)14(2分)Cl2+ 2OH-= ClO-+ Cl-+ H2O
(1分) > (1分)ClO-+ H2O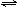 HClO+ OH-(1分)
HClO+ OH-(1分)
(3) Cl2+ CO32-+ H2O = HClO + Cl-+ HCO3- (2分)
[专题综合]
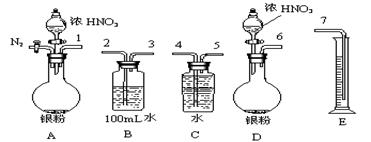
16. 某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
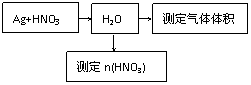

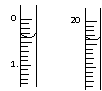

(1)测定硝酸的物质的量
 反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为
mol,则Ag与浓硝酸反应过程中生成的NO2体积为
mL。
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为
mol,则Ag与浓硝酸反应过程中生成的NO2体积为
mL。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过
程中 (填“有”或“没有”)NO产生,作此判断的
依据是 。
1.x是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物.X的化学式为_____________。
(2)若X为单质,X用于焊接钢轨时,发生反应的化学方程式为_____________。
(3)若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气
体B。等物质的量的A和B在水溶液中反应又生成X。
常温下X与足量稀氢氧化钠溶液反应的离子方程式为_____________。
II.铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为: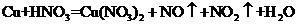 (未配平)
(未配平)
(1)硝酸在该反应中的作用是_____,该反应的还原产物是_____。
(2)0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是_____,如果得到的N0和
NO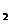 物质的量相同,则参加反应的硝酸的物质的量是_____,若用捧水法收集
物质的量相同,则参加反应的硝酸的物质的量是_____,若用捧水法收集
这些气体,可得标准状况下的气体体积_____。
(3)如果参加反应的Cu平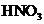 的物质的量之比是5:14,写出并配平该反应的离子
的物质的量之比是5:14,写出并配平该反应的离子
方程式________________________________________。
15.(山东省实验中学2009届高三第三次诊断)
14. A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:
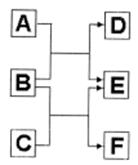 (1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气体。
(1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气体。
①B、D、F皆为非金属单质,且D为气体。
则A的结构式为 。
②B与C反应生成E和F的化学方程式为
(2)若B是由两种短周期元素组成的离子化合物,A、C为氧化物,E为气体单质,D、F是均有三种元素组成的离子化合物,它们的水溶液均呈碱性,相同浓度时D溶液 的pH大于F。则:B和C反应生成E和F的化学方程式为 ,列举该反应的一种用途 。
13. 有下图所示的反应关系:A是中学化学中常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。 (1)若A与NaOH反应,既可生成B,也可生成C,还可生成B+C,写出符合上述反应关系的A的两种不同类型物质的分子式
(2)若A与NaOH无论以何种比列反应,其产物均是B+C,则A的分子式可能是(只要求写一种);R在A、B、C中的化合价必须满足的条件是必介于B、C之间。
12.(山东2008-2009学年无棣二中第五次月考试题4月)如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
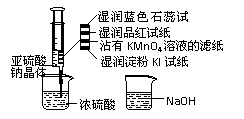 A.蓝色石蕊试纸先变红后褪色
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色
证明了SO2漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.实验室用氨水溶液除去多余的SO2
11.(山东省聊城一中08-09高三期末综合)一氯氨(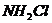 )中氨基离子带负电荷,预计它跟水反应的最初生成物是 ( )
)中氨基离子带负电荷,预计它跟水反应的最初生成物是 ( )
A. 和HCl
B.
和HCl
B.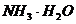 和HCl
和HCl
C.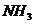 和HC1O
D.
和HC1O
D.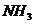 和
和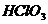
10.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过
程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是( )
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.NOx、CO、CO2均能与人体中的血红蛋白结合
C.CO在铂表面可能和O2、NOx反应
D.汽车尾气中NOx在铂表面发生反应的产物是N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com