
24.(8分)将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体的平均相对分子质量为 ,其中N2和 H2的体积比
等于 ;
(2)达到平衡时混合气体中的氨的物质的量等于 ;
(3)平衡时N2的转化率等于 。
23.(8分)在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(气)+B(气) xC(气)+2D(气),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(气)+2D(气),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________; (2)B的平衡浓度为____________;
(3)A的转化率为________; (4)生成D的反应速率为____________;
22.(6分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1) 体系中发生反应的化学方程式是
______________________;
(2) 计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3) 该反应达到平衡后容器内压强与反应前压强之比等于__________________.(填最简整数比)
21.(4分)在可逆反应3A(气)+B(气) 2C(气)+2D(气)进行的过程中,当各物质的反应速率分别有下列关系时,试判断该反应的正逆反应速率的大小关系分别是:(用“<”、或“>”、或“=”来填空)
2C(气)+2D(气)进行的过程中,当各物质的反应速率分别有下列关系时,试判断该反应的正逆反应速率的大小关系分别是:(用“<”、或“>”、或“=”来填空)
(1)υ正(A)=3υ逆(B), υ正 υ逆
(2) υ正(A)=3υ逆(C), υ正 υ逆
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
20.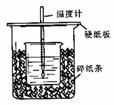 (14分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所 示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(14分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所 示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
19.(6分)(1)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水分解反应的热化学方程式 。
(2)已知16g固体单质S完全燃烧SO2气体时,放出148.4kJ的热量,则该反应的热化学方程式为 。
18.一定温度下,在固定容积的密闭容器中,可逆反应:
mA(气)+nB(气)  pC(气)+qD(气), 当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m molA 同时消耗q mol的D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;
pC(气)+qD(气), 当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m molA 同时消耗q mol的D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;
⑤反应速率vA:vB:vC:vD=m:n:p:q;⑥各组分的质量分数不再改变;⑦反应混合物中各物质的物质的量之比为m:n:p:q。其中,一定能说明反应已达到平衡状态的是 ( )
A、③④⑦ B、①③④⑤ c、②③⑤⑥ D、③⑥
第II卷 (非选择题共46分)
17.在密闭容器中充入4 mol X,在一定的温度下4X(g) 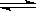 3Y (g) + Z (g),达到平衡时,有30%的X发生分解,则平衡时混合气体总物质的量是
( )
3Y (g) + Z (g),达到平衡时,有30%的X发生分解,则平衡时混合气体总物质的量是
( )
A. 3.4mol B. 4 mol C. 2.8 mol D. 1.2 mol
16.据人民网2001年9月4日报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为: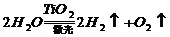 。有下列几种说法:① 水分解反应是放热反应;② 氢气是一级能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是
( )
。有下列几种说法:① 水分解反应是放热反应;② 氢气是一级能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是
( )
A. ①② B. ②③ C. ③④ D. ①②③④
15.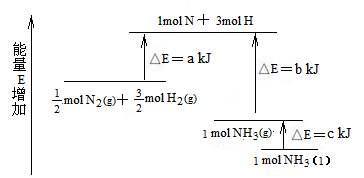 化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g) = 2NH3(l); ⊿H = 2(a-b-c)kJ/mol
B.N2(g)+3H2(g) = 2NH3(g) ; ⊿H = 2(b-a)kJ/mol
C.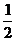 N2(g)+
N2(g)+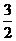 H2(g)
=
NH3(l) ;⊿H = (b+c-a)kJ/mol
H2(g)
=
NH3(l) ;⊿H = (b+c-a)kJ/mol
D.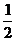 N2(g)+
N2(g)+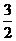 H2(g)
=NH3(g)
;⊿H
=
(a+b)kJ/mol
H2(g)
=NH3(g)
;⊿H
=
(a+b)kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com