
3、有人设计溴苯的制取装置如图所示,按要求填空:
(1)反应式为 。
(2)在滴入混合液几秒种后,能观察到的现象是:
(I)处:
(Ⅱ)处:
2、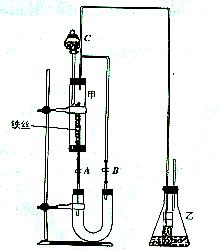 某学生在如图所示的装置中用苯和兴溴制取溴苯,请根据下列实验步骤回答有关问题。
某学生在如图所示的装置中用苯和兴溴制取溴苯,请根据下列实验步骤回答有关问题。
(1)第一步,在分液漏斗中依次加入10mL苯和5mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。
第二步,打开分液漏斗活塞,将苯、溴混合液按一定速度 逐滴加入玻璃管甲中的铁丝上,观察到的现象是: ;从上述两步观察到的现象差异,可得出的结论是: 。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是 ;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是: 。
(3)第四步,关闭胶皮管夹A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到溴苯的颜色是 ,它在U形管中液体的 (填“上”或“下”),此步关闭管夹A和B的目的是: 。
 (4)要证明上述溴跟苯的反应是取代而不是加成反应,装置乙中:小试管内的液体是 (填名称),作用是
;锥形瓶内的液体是
(填名称),作用是 ;反应后,向锥形瓶内滴加试剂
(填名称)溶液,作用是 ;此外,装置乙还能起到 的作用。
(4)要证明上述溴跟苯的反应是取代而不是加成反应,装置乙中:小试管内的液体是 (填名称),作用是
;锥形瓶内的液体是
(填名称),作用是 ;反应后,向锥形瓶内滴加试剂
(填名称)溶液,作用是 ;此外,装置乙还能起到 的作用。
(5)写出上述苯跟溴反应的化学方程式: 。
1、如图所示,为实验室制取少量溴苯的装置,简答下列问题:
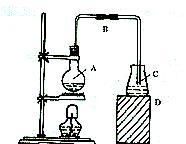
(1)烧瓶A中,装的物质为 ,发生反应的化学方程式为 。
(2)导管B的主要作用是 。
(3)导管中C处附近会出现白雾,其原因是 。
(4)反应后,向锥形瓶口中滴加AgNO3溶液时观察现象是 ,相应的离子方程式为 。
(5)反应后,将烧瓶A中的液体倒入盛有冷水的烧杯中,烧杯底部有 色的油状液体,带色的原因是 ,可用 方法将颜色除去。
5、烧瓶中生成的溴苯因溶处溴而显褐色,其提纯的方法是:将溶有溴的溴苯倒入盛有NaOH溶液的烧杯中,振荡,溴苯的密度大于水,沉在下层,用分液漏斗分离出溴苯。
Br2+2NaOH=NaBr+NaBrO+H2O
4、导管口附近出现的白雾,是HBr遇水蒸气所形成的,鉴别生成HBr的方法是:取锥形瓶内溶液少许滴加AgNO3溶液,观察是否有淡黄色的AgBr沉淀生成。
3、导管出口不能伸入水中,因HBr极易溶于水,因此要防止水倒吸。
苯的溴代反应注意事项
1、制溴苯的反应,真正起催化作用的是FeBr3; 2、跟瓶口垂直的长玻璃管起导气和冷凝的作用。
18、实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合液,加入反应器中。
②各室温下的混合液中逐滴加入一定质量的苯,充分振荡,混合均匀。
③在50℃-60℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤 。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸的配合酸时,操作注意事项是 。
(2)步骤③中,为了使反应在50℃-60℃下进行,常用的方法是 。
(3)步骤④中洗涤和分离粗硝基苯庆使用的仪器是 。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是 。
(5)纯硝基苯是无色,密度比水 (填“小”或“大”),具有 味的油状液体。
17、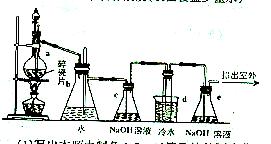 1,2-二溴乙烷可作汽油抗爆剂的添加剂。常温下,它是无色液体,密度为2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。图中:分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液;试管d中装有液溴(表面覆盖少量水)
1,2-二溴乙烷可作汽油抗爆剂的添加剂。常温下,它是无色液体,密度为2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。图中:分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液;试管d中装有液溴(表面覆盖少量水)
(1)写出本题制备1,2-二溴乙浣的两个化学反应方程式:
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因。
16、实验室用电石和水反应制备的乙炔气体中含有少量的H2S气体,为了净化和检验乙炔气体,并通过测定乙炔的体积计算电石的纯度,按下列要求填空(注意X溶液为含溴3.2%的CCl4溶液150g)
(1)试从如图所示装置中选用几种必要的装置,把它们连成一套装置,这些被选用的接口编号连接顺序是 。
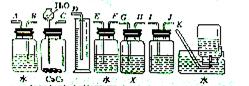
(2)实验室能否用启普发生器制乙炔,其原因是 。
(3)为了得到比较平稳的乙炔气流,常可用 代替水。
(4)假设溴水与忆炔完全反应,生成C2H2Br4,用Wg的电石与水反应后,测得排入量筒内液体体积为VmL(标准状况下),则电石纯度计算式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com