
15. 现有一定量含有Na2O杂质的Na2O2试样.请从图4-3中选用适当的实验装置,设计一个最简单的实验,则定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水).
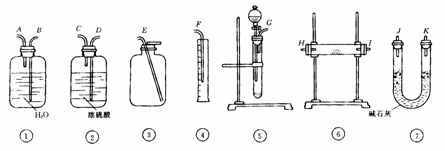
图4-3
请填写下列空白
(1)写出在实验中Na2O2和Na2O分别发生反应的化学方程式 , .
(2) 应选用的装置是(只要求写出图中装置的标号) .
(3)所选用装置的连接顺序应是(填各接口的字母,连接胶管省略)
14. 根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:
将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细
的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量
蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
|
温度 盐 溶解度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①> 35℃NH4HCO3会有分解
请回答:
⑴ 反应温度控制在30-35℃,是因为若高于35℃,则_____________________________,若低于30℃,则_____________________________,为控制此温度范围,采取的加热方法为_________________。
⑵ 加料完毕后,继续保温30分钟,目的是________________________________________。 静置后只析出NaHCO3晶体的原因是___________________________________________。 用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示)
⑶ 过滤所得的母液中含有___________________________(以化学式表示),需加入_______,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl
⑷ 测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水 溶解,加1-2滴酚酞指示剂,用物质的量浓度为c( mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+==HCO3-反应的终点),所用HCl溶液的体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
NaHCO3% = ______________________________。
13. 海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
 食盐+H2O
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
食盐+H2O
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
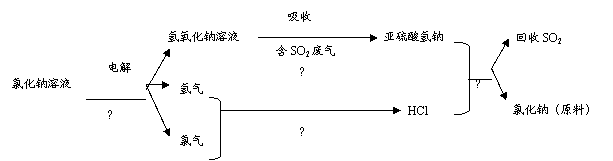 (4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
写出②④的化学反应方程式:
⑸ 上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
12、贴有A、B、C、D标签的四瓶无色溶液,已知它们是。根据下列实验现象,回答问题:
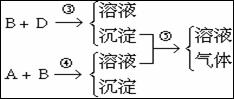
(1)写出各试剂瓶中溶质的化学式:
A B C D ____
(2)写出各步反应的离子方程式:
‚ ƒ „ … ____
11. 有M,R,Q,V,W,X,Y,Z八种物质,它们之间存在如下关系:
‚ ƒ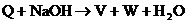
„
…
其M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。
回答下列问题:
(1)写出各代号的化学式(或分子式)
M , R ,Q ,V ,W ,X ,
Y ,Z
(2)写出下列有关化学反应的方程式和离子方程式,并标出电子转移方向和总数
反应ƒ , 反应… ,
10、下列有碱金性铷(Rb)的叙述中,正确的是
A.灼烧氯化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
9、将CO2分别通入下列各溶液中,不可能产生沉淀的是
A.CaCl2溶液 B.石灰水 C.饱和Na2CO3溶液 D.BaCl2溶液
8.、关于Na2CO3和NaHCO3性质的有关叙述正确的是
A.在水中溶解性:Na2CO3<NaHCO3 B.热稳定性:Na2CO3>NaHCO3
C.与酸反应的速度:Na2CO3<NaHCO3 D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
7、用NA表示阿伏加德罗常数,下列说法不正确的是
A.2.3gNa与水反应,产生H2 0.1 NA个
B.1mol O2在反应中作氧化剂时所得电子数一定为4NA
C.1mol钠与水完全反应,被还原的水分子为NA个
D.1mol/L NaOH溶液中所含的钠离子数为NA
6、有关纯碱晶体(Na2CO3·10H2O)的叙述中,错误的是
A.加热晶体能生成NaHCO3 B.将晶体放置空气中质量会减轻
C.Na2CO3可做干燥剂 D.晶体溶于水后具有碱的性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com