
4.已知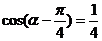 ,则
,则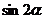 的值为
( )
的值为
( )
A.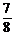 B.
B.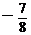 C.
C. D.
D.
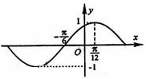 5.下列函数中,图象的一部分如右图所示的是 ( )
5.下列函数中,图象的一部分如右图所示的是 ( )
A.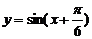 B.
B.
C. D.
D.
3. 已知向量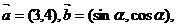 且
且 ∥
∥ ,则
,则 = ( )
= ( )
A.  B.
B. C.
C.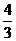 D.
D.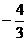
2.若 的值是 ( )
的值是 ( )
A.4 B.5 C.6 D.7
1.设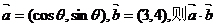 的最小值是 ( )
的最小值是 ( )
A.-3 B.-4 C.-5 D.0
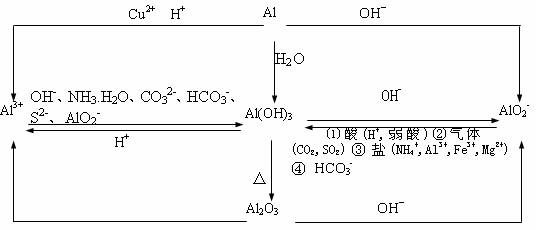
2. 铝的知识主线
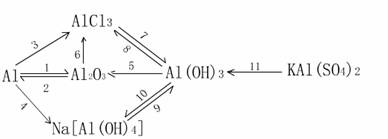
上图1-12的有关化学方程式如下:
①  4Al
+ 3O2 =2Al2O3
4Al
+ 3O2 =2Al2O3
②
 2Al2O3
==== 4Al +3O2↑
2Al2O3
==== 4Al +3O2↑
③ 2Al + 6HCl = 2AlCl3 +3H2↑
④
 2Al + 2NaOH + 6H2O= 2Na[Al(OH)4]
+3H2↑
2Al + 2NaOH + 6H2O= 2Na[Al(OH)4]
+3H2↑
⑤ 2Al(OH)3 ====Al2O3 + 3H2O
⑥ Al2O3 +6HCl =2AlCl3 + 3H2O
⑦ AlCl3 +3NH3·H2O + Al(OH)3↓ +3NH4Cl
⑧ Al(OH)3 +3HCl = AlCl3 + 3H2O
⑨ Na[Al(OH)] + CO2 = Al(OH)3↓ + NaHCO3
⑩ Al(OH)3 +NaOH = NA[Al(OH)4]
⑪ 2KAl(SO4)2 + 6NH3·H2O = 2Al(OH)3↓ + K2SO4 +3(NH4)2SO4
|

[例1](2010上海卷)甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少 D.甲中和乙中的沉淀可能一样多
答案:BD
解析:此题考查了元素化合物知识。根据氢氧化铝的性质,其能溶于氢氧化钠但不溶于氨水,故此加入时,两烧杯中生成的都是氢氧化铝沉淀;相同体积相同pH的两溶液中的溶质氨水大于氢氧化钠,当两者均不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;氨水过量,氢氧化钠恰好时,生成的沉淀一样多;氨水和氢氧化钠都过量时,生成的沉淀氨水多;可知BD正确。
解法点拨:此题解答时,选用的是讨论法,其多用在计算条件不足,据此求解时需要在分析推理的基础上通过某些假设条件,加以讨论才能正确解答;故此在应用讨论法解题时,关键是先要分析条件与求解问题之间的联系,形成正确的解题方法。
[例2](2010重庆卷,8)下列叙述正确的是
A.铝制容器可盛装热的H2SO4
B.Agl胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈
D.红磷在过量Cl2中燃烧生成PCl3
1. 镁的知识主线
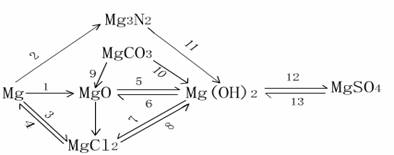
上图的1-13中的有关化学方程式如下:
①
|
② 3Mg+N2 === Mg3N2
③
|
|
④
|
|
⑤
|
⑥ Mg(OH)2 === MgO+H2O
⑦ Mg(OH)2+2HCl=MgCl2+2H2O
⑧ MgCl2+2NaOH=Mg(OH)2↓+2NaCl
⑨
|
|
⑩ MgCO3+H2O===Mg(OH)2+CO2↑
⑪ Mg3N2+6H2O=3Mg(OH)2+2NH3↑
⑫ Mg(OH)2+H2SO4=MgSO4+2H2O
⑬ MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
3. 能列举合金材料的重要应用.
|

镁铝及其化合物
(1)镁是活泼金属,虽不跟碱性溶液反应,但能置换出酸中的氢,也能与水解呈酸性的盐溶液反应产生H2。
(2)注意对Al2O3、Al(OH)3两性的理解,以及对Al3+、AlO2-存在条件的认识。
Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中均不溶),Al3+、AlO2-只能分别存在于酸性与碱性溶液中。
Al3+与下列离子不能大量共存:OH-、CO32-、HCO3-、SO32-、S2-、AlO2-,其中OH-是因为直接反应,其余均是“双水解”。
AlO2-与下列离子不能大量共存:H+、HCO3-、NH4+、Al3+、Mg2+、Cu2+。其中H+和HCO3-是因为直接反应(AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-),其余也是“双水解”。
(3)注意正确理解图象的涵义。
图示中每个曲线或每条曲线的转折点(拐点),都反映了特定的反应,若没有找对,或对生成沉淀和沉淀溶解所需加入(或通入)溶液(或气体)的量之比没搞清,易导致错误。
注意研究以下几个实验现象及产生沉淀的量与加入物质的量的数量关系的图象:
①向AlCl3溶液中逐滴加入NaOH溶液直至过量;②向AlCl3和MgCl2混合中逐滴加入NaOH溶液直至过量;④向HCl、MgCl2、AlCl3混合液中逐滴加入NaOH溶液直至过量;③向NaAlO2溶液中逐滴加入HCl溶液直至过量;⑤向HCl溶液中逐滴加入NaAlO2溶液直至过量。
这些是以化学知识为载体考查学生的综合能力的重要的命题内容,认真研究一定会有益处。
(4)Mg(OH)2的溶解度小于MgCO3。所以在碱性溶液中Mg2+总是转化为Mg(OH)2沉淀,产生的MgCO3也会在加热的条件下逐渐转化为Mg(OH)2[MgCO3+H2O(沸水)=Mg(OH)2+CO2↑]。
|

第1课时 镁、铝及其化合物
2. 通过合金材料了解铝及化合物的性质.
1. 通过海水制镁的事例了解镁及化合物的性质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com