
6.用电子式表示下列物质:氟化钙 ,氧化钾 。
5.下列说法中,正确的是
A. 相邻的原子之间的相互作用叫做化学键
B. 金属和非金属元素的相互化合,都能形成离子键
C. 非金属元素的原子半径比其离子半径小(氢除外),金属元素的原子的原子半径比其离子半径大
D. 甲元素原子半径比乙元素原子半径大,则甲的离子半径一定比乙的原子半径大。
4.下列电子式书写正确的是
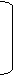
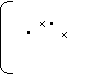

|
|
|
|
|
|
|
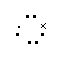

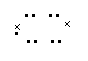
|
3. bXn-和aYm+两种离子的电子层结构相同,a则为
A. b-m-n B. b-m+n C. b+m+n D.b+m-n
2.下列化合物中,阴离子和阳离子的半径之比最大的是
A.CsI B. NaF C. LiI D. KCl
1.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
A. 6和8 B. 11和13 C. 11和16 D. 12和17
11.(12分)A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请回答:
(1)用化学符号表示上述5种微粒:
A_________,B_________,C_________,D_________,E_________。
(2)在水溶液中A跟B反应的离子方程式是:_______________________________________。
专题1 微观结构与物质的多样性
第2单元 他微粒之间的相互作用力
课时6 :离子键
10.(8分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是________;Y元素的名称是________;Z元素的名称是:________。
(2)XZ3化合物的分子式是_________,电子式是_________。
(3)分别写出X、Y的含氧酸的分子式_________、_________。
9.下列事实是由于氯的非金属性比硫强的结果的是
A.次氯酸的酸性比硫酸弱 B.氯能置换硫化氢中的硫
C.常温下单质硫为淡黄色固体,而氯气为黄绿色气体
D.硫能在空气中燃烧,而氯则不能
8.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
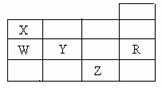 A.常压下五种元素的单质中,Z单质的沸点最高
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com