
6.管道煤气的主要成分是CO、H2和少量甲烷。相应的热化学方程式为
2H2(g)+O2(g)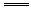 2H2O(l);△H=-571.6 kJ·mol-1
2H2O(l);△H=-571.6 kJ·mol-1
2CO(g)+O2(g)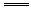 2CO2(g);△H=-566 kJ·mol-1
2CO2(g);△H=-566 kJ·mol-1
CH4(g)+2O2(g)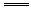 CO2(g)+2H2O(l);△H=-890.3kJ·mol-1
CO2(g)+2H2O(l);△H=-890.3kJ·mol-1
当使用管道煤气的用户改烧天然气后,在相同条件下燃烧等体积的燃气,理论上所获得的热值,后者大约是前者的
A.0.8倍 B.1.3倍 C.1.6倍 D.3.1倍
5.燃烧1g乙炔(C2H2)气体,生成液态水和二氧化碳,放出50kJ热量,则燃烧3mol乙炔所放出的热量为
A.50kJ B.150kJ C.450kJ D.3 900kJ
4. 4P(红磷s) P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
4P(红磷s) P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
3.已知H2(g)+C12(g)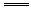 2HCl(g);△H=-184.6kJ·mol-1,则反应2HCl(g)
2HCl(g);△H=-184.6kJ·mol-1,则反应2HCl(g)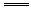 H2(g)+Cl2(g)的△H为
H2(g)+Cl2(g)的△H为
A.+92.3 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+184.6 kJ·mol-1
2.下列反应属于吸热反应的是
A.高锰酸钾分解 B.盐酸和氢氧化钠溶液混合
C.锌放入稀硫酸中 D.碳不完全燃烧生成一氧化碳
1.吸热反应一定是
A.释放能量 B.储存能量
C.需要加热才能发生 D.反应物总能量高于生成物总能量
10.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)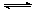 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
专题2 化学反应与能量变化
第2单元 化学反应中的热量
课时3:化学反应中的热量
9.某反应在催化剂的作用下按以下两步进行:第一步为X+Y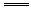 Z;第二步为Y+Z
Z;第二步为Y+Z 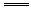 M+N+X。此反应的总化学方程式为_________________________,反应的催化剂为_______。
M+N+X。此反应的总化学方程式为_________________________,反应的催化剂为_______。
8.影响化学反应速率的外界条件主要是__________、__________、__________、__________,一般地说,其他条件不变时,__________或__________都可以使化学反应速率增大,而__________对有气体参加或生成的反应有影响。
7.某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如右图所示。由图中数据分析,该反应的化学方程式为______________________________。反应开始至2min,Z的平均反应速率为___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com