
7.为了得到函数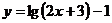 的图像,只需把函数
的图像,只需把函数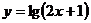 的图像上所有的点( )
的图像上所有的点( )
A.向左平移 个单位长度的,再向上平移
个单位长度的,再向上平移 个单位长度
个单位长度
B.向右平移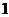 个单位长度的,再向上平移
个单位长度的,再向上平移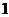 个单位长度
个单位长度 

C.向左平移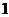 个单位长度的,再向下平移
个单位长度的,再向下平移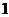 个单位长度
个单位长度
D.向右平移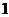 个单位长度的,再向下平移
个单位长度的,再向下平移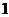 个单位长度
个单位长度
6.若函数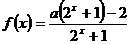 是奇函数,则
是奇函数,则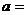 ( )
( )
A.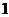 B.
B.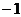 C.
C.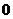 D.
D.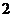
5.若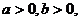 且
且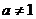 ,则
,则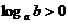 是
是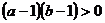 的( )
的( )
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.既不充分又不必要条件
4.如果命题“非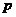 或非
或非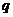 ”是假命题,则在下列各结论中正确的是( )
”是假命题,则在下列各结论中正确的是( )
①命题“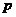 且
且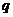 ”是真命题;
②命题“
”是真命题;
②命题“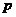 且
且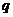 ”是假命题;
”是假命题;
③命题“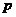 或
或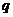 ”是真命题;
④命题“
”是真命题;
④命题“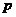 或
或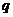 ”是假命题。
”是假命题。
A.①③ B.②④ C.②③ D.①④
3.设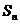 为等差数列
为等差数列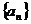 的前
的前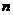 项和,若满足
项和,若满足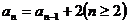 ,且
,且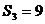 ,则
,则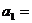 ( )
( )
A.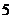 B.
B.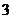 C.
C.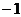 D.
D.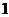
2.函数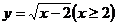 的反函数为( )
的反函数为( )
A.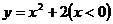 B.
B.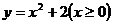
C.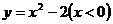 D.
D.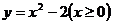
1.设集合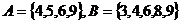 ,全集
,全集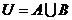 ,则集合
,则集合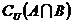 的元素个数共有( )
的元素个数共有( )
A.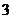 个
B.
个
B.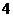 个
C.
个
C.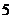 个
D.
个
D.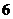 个
个
3.铝盐和偏铝酸盐
(1) 铝盐性质:
①铝盐溶液发生水解反应,使溶液呈酸性。
思考:明矾的化学式为 ,在日常生活中明矾用于 。②铝盐与碱溶液反应
与强碱溶液发生反应:适量强碱:
过量强碱:
与弱碱(氨水)发生反应:
思考:写出Al2(SO4)3溶液与Na2S、NaHCO3、Na2CO3溶液反应的离子方程式。
(2) 偏铝酸盐性质:
①偏铝酸盐溶液发生水解反应,溶液呈碱性。
②偏铝酸盐与酸反应
与强酸发生反应:适量强酸:
过量强酸:
与弱酸(H2CO3)发生反应:即通入CO2气
适量CO2:
过量CO2:
③铝盐与偏铝酸盐溶液反应:
思考:分析以下几种情况中Al3+与强碱反应,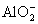 与强酸反应的现象及图像
与强酸反应的现象及图像
①把强碱溶液逐滴加入到铝盐(Al3+)中至过量:
②把 铝盐(Al3+)逐滴加入到强碱中至过量:
③在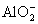 溶液中逐滴加入强酸至过量:
溶液中逐滴加入强酸至过量:
④在强酸溶液中逐滴加入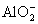 至过量:
至过量:
试题枚举
[例1]1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用,铝在下列应用时应加以控制的是 ( )
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾和苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药品 ⑦银色漆颜料 ⑧制易拉罐 ⑨包装糖果和小食品
A.全部 B.③⑤⑧⑨ C.⑥⑧⑨ D.③④⑤⑥⑧⑨
解析: “D”中所涉及的铝与进入食品、饭、水等中,并被人体吸收,所以要加以控制。
答案: D
[例2]在下列各物质中,加入过量盐酸后,最终不产生沉淀或浑浊的是
A.偏铝酸钠溶液 B.苯酚钠溶液 C.硅酸钠溶液 D.硫代硫酸钠溶液
解析:各选项中产物依次为Al(OH)3、C6H5OH、H2SiO3、S。但Al(OH)3是两性氢氧化物,能溶于过量的盐酸中。
答案:A
[变式]将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
[例3]将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
解析:在镁、铝混合物中加入HNO3和浓H2SO4(两物质均具有强氧化性)都不能产生H2,加入NaOH溶液只有Al与NaOH溶液反应生成H2而与Mg不反应。而加入HCl,Mg和Al都与盐酸反应生成H2,所以H2量最多。
答案:A
[例4]甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.6g
解析:根据铝与盐酸和氢氧化钠溶液反应的方程式判断,若在含等物质的量的HCl和NaOH溶液中分别加入足量的铝粉,产生的H2之比为1:3。而题中为1:2,说明铝粉的量相对盐酸是过量的,而对NaOH是不足的。与前者反应的铝粉是2.7g,则与后者反应的铝粉应为5.4g。
答案:A
[变式] 氢化钠是一种离子晶体,它与水反应时生成氢氧化钠和氢气,现有氢化钠和铝粉m g,与足量的水反应后铝无剩余,若收集到氢气n g,则混合物中铝粉的质量为:( )
A.36n-3m B.m-24n/5 C.12n-m D.24m-5n
[例5]若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Ca2+ K+ Cl- D.NO3- K+ AlO2- OH-
解析:铝粉加入酸溶液或强碱溶液中均可放出H2,A中NH4+与OH-不能大量共存,CO32-不能与H+大量共存;B中HCO3-既能与H+反应又能与OH-反应;C、D在强碱条件下可以共存。
答案:C、D
[例6]已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
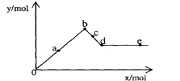 A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量: BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
解析:设A12(SO4)3溶液中含1mol A12(SO4)3,既含2molAl3+和3molSO42-。
[o-a-b] 离子反应:2molAl3+ + 3molSO42- + 3Ba2+ + 6OH- = 3BaSO4↓+2Al(OH)3↓
沉淀为BaSO4 和Al(OH)3 其物质的量之比为 3:2 。b点达最大值,为5mol,此时加入的Ba(OH)2为3mol
(b-c-d )加入的Ba(OH)2,仅OH- 参与离子反应: 2Al(OH)3 + 2OH- = 2AlO2- + 4H2O 每消耗2mol OH-则生成2AlO2-,是留在溶液中Ba2+的两倍。沉淀混合物中Al(OH)3随加入的Ba(OH)2不断溶解.当加入的Ba(OH)2为4mol时, Al(OH)3沉淀恰好溶解完。d点沉淀达最小值组成全为BaSO4, 既y=3mol ,x=4mol. 此时,若不考虑AlO2-的水解,反应后溶液中溶质仅为1mol Ba(AlO2)2, 既 1mol Ba2+ 和 2molAlO2-
[d-e---] 再加入的Ba(OH)2 不发生离子反应,沉淀量不变,只是增加了溶液中的Ba2+和OH- 离子.显然,当再加入1mol Ba(OH)2 ,既x=5mol ,此时溶液中的n(Ba2+)=1mol+1mol=2mol, n(OH-)=2mol , 两种离子的物质的量相等.
答案:B D.
[例7]
 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是
|
|
A |
B |
C |
D |
|
X |
H2S |
HCl |
NH3 |
NH3.H2O |
|
Y |
Na2SO3 |
NaAlO2 |
AlCl3 |
AgNO3 |
解析:由图可知,B中加入试剂1份,沉淀完全,再加入3份,
沉淀全溶解。
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O
A中二者反应生成S,继续通入不溶解;C中通入NH3生成沉淀,继续通入也不溶;而D中AgNO3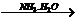 AgOH↓
AgOH↓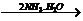 [Ag(NH3)2]++OH-。
[Ag(NH3)2]++OH-。
答案:B
2.氢氧化铝
①)物理性质
Al(OH)3是 固体, 溶于水,若溶液中生成,Al(OH)3为 物,且有吸附水中悬浮物和色素的能力
②化学性质(典型的 氢氧化物)

 H++AlO2-+H2O Al(OH)3 Al3++3OH-
H++AlO2-+H2O Al(OH)3 Al3++3OH-
与强酸反应,其离子方程式为
与强碱溶液反应,其离子方程式为
热不稳定性:
③制备方法:
实验室中制取少量的氢氧化铝常用可溶性的铝盐与 反应,反应的离子方程 式为 。
思考:能否用可溶性的铝盐与强碱反应制取?
1.氧化铝
①)物理性质
Al2O3是 固体,其天然晶体叫 ,硬度大,熔点高(为2072℃),是很好的耐火材料
②化学性质(典型的 氧化物)
与强酸反应,其离子方程式为
与强碱溶液反应,其离子方程式为
思考:铝与强碱溶液反应的实质是什么?标出其电子转移方向和数目。
③用途
作 材料,如制 、 等;作冶炼铝的原料;红、蓝宝石。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com