
15、(16分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1) Z2Y的化学式是
(2) Z2Y2与X2Y反应的化学方程式是 。
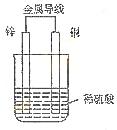
(3) 如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)
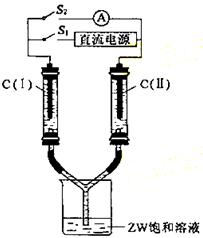 为多孔石墨电极。
为多孔石墨电极。
 接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
C(Ⅱ)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是: 。
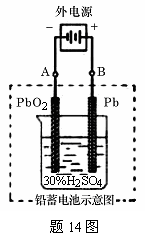
14、(14分)铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是___________________________
____________________________________________________;电解液中H2SO4的浓度将变________________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按题14图连接,电解一段时间后,则在A电极上生成________________________、B电极上生成_______________________,此时铅蓄电池的正负极的极性将_______________________________。
13、(14分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是________________________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
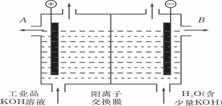
①该电解槽的阳极反应式是________________________________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因___________________________
_______________________________________________________________________________________________________________________________________________。
③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出。
12、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
11、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的
镍,下列叙述正确的是 ( )
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阴极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
10、.关于如图所示装置的叙述,正确的是 ( )
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
9、关于电解NaCl水溶液,下列叙述正确的是 ( )
A.电解时在阳极得到氯气,在阴极得到氢气和氢氧化钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
 D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
8、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4
+ 8H2O 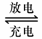 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
3Zn(OH)2 + 2Fe(OH)3
+ 4KOH
下列叙述不正确的是 ( )
A.放电时负极反应为:Zn - 2e- + 2OH- == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- == FeO42- + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
7、一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是 ( )
A.在熔融电解质中,O2- 由负极移向正极
B.电池的总反应是:2C4H10 + 13O2→ 8CO2 + 10H2O
C.通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2-== 4CO2 + 5H2O
6、锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是 ( )
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com