
8.(共15分,方程式每空3分,其余每空2分)
(1)正四面体N≡N
(2)因为水分子间存在氢键
(3)2H2O+2F2==4HF+O2
(4)t0=t1,升高温度、减小压强(增大体积)
8.(15分)Q、R、X、Y、Z为五种常见的短周期元素。Q所在周期序数等于核外电子数;R、Z同主族,R的单质是空气的主要原分之一;Z的单质有多种同素异形体;Y是同周期中原子半径最小的元素;Q、R的最外层电子数这和等于X的最外层电子数,Q与R、X、Y可分别形成电子总数相等的分子。
请回答下列问题:
(1)Z元素的一种单质为白色蜡状固体,其分子的空间构型为 ,R元素单质分子的结构式为 ;
(2)X的氢化物是所在族元素的氢化物中沸点最高的,其原因是 ;
(3)Y的单质与水发生反应的化学方程式为 ;


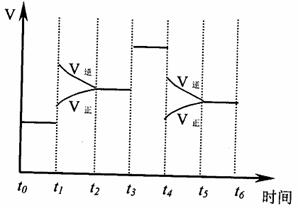
 (4)Q、R的单质在密闭容器中可以发生反应3Q2(g)+R2(g) 2RO3(g);△H<0,
(4)Q、R的单质在密闭容器中可以发生反应3Q2(g)+R2(g) 2RO3(g);△H<0,
下图是反应速率与反应时间的曲线关系图。
其中表示平衡混合物中RO3的含量最高的一段时间是 ,t1、t4时刻可能采取的措施分别为 、 。
7.
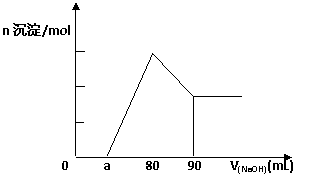 将一块镁铝合金投入1 mol·L-1 的一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1 mol·L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位为mL)的关系如图,下列说法中不正确的是 D
将一块镁铝合金投入1 mol·L-1 的一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1 mol·L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位为mL)的关系如图,下列说法中不正确的是 D







 A.
由图可以确定该镁铝合金中铝的质量为0.27克
A.
由图可以确定该镁铝合金中铝的质量为0.27克
 B.
当滴入1 mol·L-1的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3
B.
当滴入1 mol·L-1的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3
 C.
由图可以确定该合金中镁铝物质的量之比
C.
由图可以确定该合金中镁铝物质的量之比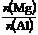 的最大值为2.5
的最大值为2.5
 D.
由图可以确定
D.
由图可以确定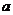 的取值范围为:0 ≤ a ≤
50
的取值范围为:0 ≤ a ≤
50
5. 常温下,水的离子积为Kw,下列说法正确的是 ( C
)
常温下,水的离子积为Kw,下列说法正确的是 ( C
)


|
 B.将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7
B.将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7
 C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=
C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=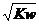
 D.若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14
D.若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14

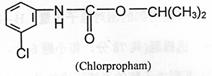 6.氨基甲酸酯类农药在环境中易分解,在生物体内能迅速代谢,而其代谢产物毒性多数低于其本身毒性,是属于低残留的农药。除草剂N-(间-氯苯基)氨基甲酸异丙酯的结构简式如下,下列有关叙述正确的是(
D )
6.氨基甲酸酯类农药在环境中易分解,在生物体内能迅速代谢,而其代谢产物毒性多数低于其本身毒性,是属于低残留的农药。除草剂N-(间-氯苯基)氨基甲酸异丙酯的结构简式如下,下列有关叙述正确的是(
D )
A.分子式是C10H9NO2Cl
B.该物质水解后可能生成α--氨基酸
C.该物质苯环上最多还能形成3种一溴取代物
D.该物质属于芳香烃的衍生物
4. 已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+.下列叙述不正确的是 ( B )
已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+.下列叙述不正确的是 ( B )
 A.氧化产物为Cl2
A.氧化产物为Cl2
 B.氧化剂与还原剂的物质的量之比为1:6
B.氧化剂与还原剂的物质的量之比为1:6
 C.若有3molH2O生成,则反应中有2mol电子转移
C.若有3molH2O生成,则反应中有2mol电子转移
 D.微粒的还原性Cl->Co2+
D.微粒的还原性Cl->Co2+
3.t℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(I)所示。保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是 ( B )
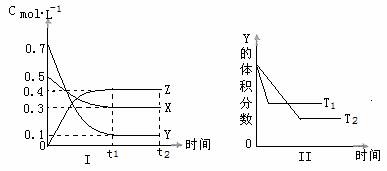
A.t2时刻,保持其它条件和物质状态不变,增加压强,化学平衡向逆反应方向移动
B.t℃时,若密闭容器中X、Y、Z的起始浓度依次为: 。保持其他条件不变,达到平衡时Z的浓度为 0.4
mol•L-1
。保持其他条件不变,达到平衡时Z的浓度为 0.4
mol•L-1
C.若图(Ⅱ)中T1>T2,则正反应是吸热反应
D.其他条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
1.下列有关实验的叙述正确的是B
 A.碱金属单质都可保存在煤油中
A.碱金属单质都可保存在煤油中

 B.浓碱液沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
B.浓碱液沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
 C.胶头滴管一定不能伸入液面以下进行相关实验
C.胶头滴管一定不能伸入液面以下进行相关实验
 D.高锰酸钾标准液可用碱式滴定管取用
D.高锰酸钾标准液可用碱式滴定管取用
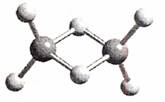 2.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化俣物的分子式为Al2H6,它的熔点为150℃,
2.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化俣物的分子式为Al2H6,它的熔点为150℃,
 燃烧热极高。Al2H6球棍模型如下图。下列有关说法
燃烧热极高。Al2H6球棍模型如下图。下列有关说法
肯定错误的是 ( D )
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
8.若α、β均为锐角,且tanα=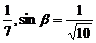 ,求α+2β的值.
,求α+2β的值.
7.已知cos(α-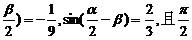 <α<π,0<β<
<α<π,0<β<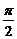 ,求cos(α+β)的值.
,求cos(α+β)的值.
6.(2002年全国高考题)已知sin22α+sin2αcosα-cos2α=1,α∈(0,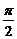 ).求sinα,tanα的值.
).求sinα,tanα的值.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com