
5、已知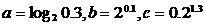 ,则
,则 的大小关系是
的大小关系是
4、如果sin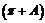 =
=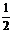 ,那么cos
,那么cos 的值是
的值是
2、点P(tan2008º,cos2008º)位于
3、.函数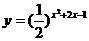 的值域是
的值域是
1、若对 ,
,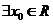 ,使
,使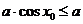 成立,则
成立,则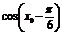 的值为
的值为  D 的
D 的
11. (1)C3H8O3 (2分)
 (2)(4分)
(2)(4分)


(3)(9分)
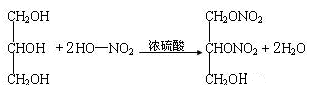

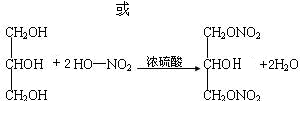
酯化反应

(4)(2分)
11. 已知: ①无机含氧酸和羧酸一样可以与醇发生酯化反应。
 ② RCH(OH)2
② RCH(OH)2 RCHO+H2O
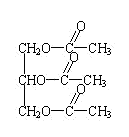
现有只含C、H、O的化合物A~E,其中A为饱和多元醇,其它有关信息已注明在下图的方框内。
RCHO+H2O
现有只含C、H、O的化合物A~E,其中A为饱和多元醇,其它有关信息已注明在下图的方框内。
回答下列问题: (1)A的分子式为 ; (2)写出下列物质的结构简式:B ;D ; (3)写出下列反应的化学方程式和反应类型: A→C: ,反应类型: ; D与银氨溶液反应: ,反应类型: ; (4)D的某同分异构体H能与碳酸氢钠溶液反应生成二氧化碳,两分子H可以生成六元环状化合物,写出H发生缩聚反应的方程式______________________________________。
10. (14分)(1)
(14分)(1)
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
酸耗较少,产生NOx的量较少(2分) |
反应速率慢(1分) |
(2)a、c(2分填一个对的得1分,填两个对的得2分,一对一错和两对一错等不得分)
(3)稀释后,H+浓度减小,促进Fe3+、Cu2+的水解(3分)
(4)造成步骤D过滤和步骤E蒸发耗时长(2分) (5)蒸发浓缩(2分)
(6)Cu(NO3)2+Ag2O+H2O = 2AgNO3+Cu(OH)2(2分)
10.(14分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:

⑴工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
⑵步骤B加热保温的作用是 :
a. 有利于加快反应速率 b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
⑶步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 ;
⑷步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:
;
⑸步骤E进行的操作是 。
 ⑹制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为:
。
⑹制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为:
。
9.(1) 1、5、3、3、3、3
(2) 层呈紫红色,
层呈紫红色,

(3)①溶液由蓝色恰好变为无色且半分钟内颜色不恢复
②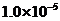
③
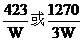
9. 市场销售的某种食用精制盐包装袋上有如下说明:
市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处);
 _____
_____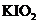 +______
+______ +______
+______ =_______
=_______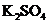 +______
+______ +______
+______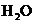
 (2)上述反应生成的
(2)上述反应生成的 可用四氯化碳检验。确认有
可用四氯化碳检验。确认有 生成的现象是_______________
生成的现象是_______________
 利用
利用 稀溶液,将
稀溶液,将 还原,可从碘的四氯化碳溶液中回收四氯化碳。
还原,可从碘的四氯化碳溶液中回收四氯化碳。 稀溶液与
稀溶液与 反应的离子方程式为____________________________________。
反应的离子方程式为____________________________________。
 (3)已知:
(3)已知: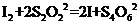 某学生测定食用精致盐的碘含量,其步骤为:
某学生测定食用精致盐的碘含量,其步骤为:

 a 准确称取 w g 食盐,加食粮蒸馏水使其完全溶解;
a 准确称取 w g 食盐,加食粮蒸馏水使其完全溶解;
 b 用稀硫酸酸化所得溶液,加入足量KI溶液,使
b 用稀硫酸酸化所得溶液,加入足量KI溶液,使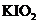 与KI反应完全;
与KI反应完全;
 c 以淀粉溶液为指示剂,逐滴加入物质的量浓度为
c 以淀粉溶液为指示剂,逐滴加入物质的量浓度为 的
的 溶液
溶液 ,恰好反应完全。
,恰好反应完全。

 ①判断c中恰好完全反应依据的现象是___________________________________。
①判断c中恰好完全反应依据的现象是___________________________________。
 ②b中反应所产生的
②b中反应所产生的 的物质的量是______________mol。
的物质的量是______________mol。
 ③根据以上实验和包装袋说明测得精制盐的碘(I)含量是(以含w的代数式表示)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量是(以含w的代数式表示)
 _______mg/kg。
_______mg/kg。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com