
13.(1)Fe3O4+8H+===Fe2++2Fe3++4H2O (2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
12. (1)NaAlO2、NaOH 0.3mol、1.2mol (2)Al2(SO4)3 0.3mol(3)乙 5/6 甲 62.4
1.CD 2.B 3.C 4.CD 5.A 6.C 7.A 8.B 9.BC 10.A 11.(1)C (2)

7.⑴4.0mol/L ⑵[0.600 mol/L,1.50 mol/L]⑶ 还可测出50.0mL混合溶液中n (Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。
[课后巩固]
6.(1)氨水 硫酸 氢氧化钾 ①过滤 ②加热 ③蒸发结晶(2)111g 116g
5.(1)这是因为脱落下来的物质是红色的氧化亚铜,它是氧化铜在高温分解时的产物。
(2)采用铜时,通电容易冒出电火花而引起事故,Au、Pt、Pd的合金作为触点不冒电火花从而克服使用铜的弊端。
(3)3CuS+8HNO3(稀)=3Cu(NO3)2+2NO↑+3S↓+4H2O,2CuS+10KCN===2K3[Cu(CN)4]+2K2S+(CN)2↑
1.B 2.BD 3.A 4.BC
19.某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,在炼铜炉内发生如下反应(在高温条件下进行):2Cu2S+3O2 = 2Cu2O+2SO2,2Cu2O+Cu2S = 6Cu+SO2
⑴若生产38.4t金属铜,需要含杂质20%的精辉铜矿多少吨(设杂质不参加反应)?
⑵若⑴中产生的二氧化硫用于制硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
⑶今将a mol Cu2S与b mol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来温度,容器内的压强为P2,请完成下列表格。
|
反应后固体的成分 |
Cu |
Cu2S、Cu |
Cu2O、Cu |
|
b的取值范围(用a表示) |
|
|
|
|
P1与P2的关系(填>、<或=) |
P1 P2 |
P1 P2 |
P1
P2 |
2010届高三化学140分突破精品资料第1讲
常见金属元素及其化合物答案
例1:思路点拨:有关Na2O2、Na2O和Na的性质这一考点最能考查学生分析问题、解决问题的能力。在求解这类问题时要运用极限思想和假设法计算,
疑难辨析:由于Na2O2和水反应放出O2,因此若不能很好地判断Na2O2和Na2O与水反应的情况则易导致错误。
解题过程:原不饱和溶液的量相同,欲使NaOH达到饱和,加入的物质含钠量越大,加入的量越少;加入的物质含钠量越小(相当于又加入了溶剂),最终加入的量就大,可用化学式假设法来进行比较。本题答案A。
|
|
NaOH |
|
Na2O2 |
|
Na2O |
|
Na |
|
化学式变形(Na+相等) |
Na2(OH)2 |
|
 |
|
Na2O |
|
Na2 |
|
除Na外,增重 |
2×17 |
|
16 |
|
16 |
|
0 |
|
饱和时,需固体的物质的量 |
n1 |
> |
n2 |
= |
n3 |
> |
n4 |
|
饱和时,需固体的质量 |
m1 |
> |
m2 |
> |
m3 |
> |
m4 |
变式训练:
答案:(1) NaHCO3为amol;Na2O2为(a+b)/2mol。(2) H2O为(a-b)/2mol;O2为(a+b)/4mol
解析:2NaHCO3 Na2CO3+CO2↑+H2O↑,受热分解产生的CO2和H2O都要和Na2O2反应,可先考虑CO2的反应(因为先考虑H2O结果相同,且先考虑CO2简便)。分析得:固体残留物为Na2CO3、NaOH,气体产物为O2和H2O。(1)根据C元素和Na元素守恒可得:NaHCO3为amol;Na2O2为(a+b)/2mol;(2)根据H元素和O元素守恒可得:H2O为(a-b)/2mol;O2为(a+b)/4mol。
Na2CO3+CO2↑+H2O↑,受热分解产生的CO2和H2O都要和Na2O2反应,可先考虑CO2的反应(因为先考虑H2O结果相同,且先考虑CO2简便)。分析得:固体残留物为Na2CO3、NaOH,气体产物为O2和H2O。(1)根据C元素和Na元素守恒可得:NaHCO3为amol;Na2O2为(a+b)/2mol;(2)根据H元素和O元素守恒可得:H2O为(a-b)/2mol;O2为(a+b)/4mol。
例2:思路点拨:根据反应发生的先后顺序再利用离子反应分析各线段所发生的反应。
疑难辨析:题目中已强调“注意线段的斜率”这一句话,所以更应明确图像表示的是一个等腰梯形,而非斜梯形。
解题过程:选项B中滴加的NaOH溶液先和HCl反应,所以一开始没有沉淀生成,不合题意。选项C所得的图形是一个斜梯形。选项D中生成的Mg(OH)2沉淀不溶于NaOH,因此沉淀量不会减少。只有选项A正确。
变式训练:
答案:(1)中和过量的酸 (2)V2×10-2mol/L (3)不会(3m/80)×103<(V2-V1)<(m/17) ×103
解析:(1)0~V1之间发生的反应为H++OH-=H2O,V1~V2之间发生的反应为Fe3++3OH-=Fe(OH)3↓,Al3+3OH-=Al(OH)3↓,V2~V3之间发生的反应为Al(OH)3+OH-=AlO2-+2H2O。(2)在V2时,溶液中的溶质为NaCl,所以有n(HCl)=n(NaOH)= V2×10-3mol,可得盐酸的浓度为V2×10-2mol/L,(3)由(2)可得混合物中Al2O3和Fe2O3按不同比例进行上述实验,V2的值会是不会改变的,V2-V1表示的是和2种金属离子反应所需NaOH的体积,用极值法进行计算,若mg混合物全为Al2O3, V2-V1 等于(m/17) ×103mL,若mg混合物全为Fe2O3,V2-V1 等于(3m/80)×103mL,由此得解。
例3:思路点拨:弄清了下面三个过程后这类问题可迅速得解:①过量的铁与浓硫酸共热的反应情况:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O;Fe+ Fe2(SO4)3=3FeSO4;Fe+H2SO4=FeSO4+ H2↑②过量的铁与浓硝酸共热的反应情况分析:Fe+6HNO3(浓)
Fe2(SO4)3+3SO2↑+6H2O;Fe+ Fe2(SO4)3=3FeSO4;Fe+H2SO4=FeSO4+ H2↑②过量的铁与浓硝酸共热的反应情况分析:Fe+6HNO3(浓)  Fe(NO3)3+3NO2↑+3H2O;3Fe+ 8HNO3(稀)= 3Fe(NO3)2+2NO2↑+4H2O;Fe+2Fe(NO3)3= 3Fe(NO3)2③当金属和混酸反应时,要用离子方程式来计算产生气体的物质的量。
Fe(NO3)3+3NO2↑+3H2O;3Fe+ 8HNO3(稀)= 3Fe(NO3)2+2NO2↑+4H2O;Fe+2Fe(NO3)3= 3Fe(NO3)2③当金属和混酸反应时,要用离子方程式来计算产生气体的物质的量。
疑难辨析:本题较为综合,没有一定的解题方法与技巧,很难完整地解决这个题目,如果按照有序思维来解决问题(1),则较易解决,也不会漏掉某种情况,同时也为(2)、(3)的解决打下一个好的基础。当题目中出现两个变量时常用有序思维来解。
解题过程:(1)按照有序思维,假设HNO3的量由少逐渐增多,从而依次确定残留固体成分及溶液中的金属离子。①Fe、Cu;Fe2+,②Cu;Fe2+,③Cu;Fe2+、Cu2+,④无;Fe2+、Cu2+,⑤无;Fe2+、Cu2+,Fe3+,⑥无;Cu2+,Fe3+。其中②为特殊情况,Fe与稀HNO3恰好反应生成Fe2+;④为Fe、Cu恰好与稀HNO3反应生成Fe2+、Cu2+,其余各种情况按HNO3的量逐渐增多来考虑,则不难确定。
(2)3Cu+8HNO3=3 Cu(NO3)2+2NO↑+4H2O;3Fe+8HNO3=3 Fe(NO3)2+2NO↑+4H2O
ax 8ax/3 a(1-x) 8a(1-x)/3
生成Fe2+、Cu2+时,总耗用硝酸量:n(HNO3)= 8ax/3+8a(1-x)/3=8a/3,铁恰好反应且生成Fe2+时耗硝酸量:n(HNO3)= 8a(1-x)/3,因此溶液中金属离子只有Fe2+、Cu2+时b的取值范围是8a(1-x)/3<b≤8a/3。(3)根据电子守恒:0.5a×2+0.25a×3+0.25a×2=672/22400×3,解得a=0.04mol,根据硝酸中的NO3-守恒可得b的值:
b==n[Fe(NO3)2] ×2+n[Fe(NO3)3] ×3+ n[Cu(NO3)2] ×2+n(NO)
==0.04mol×0.25×2+0.04mol×0.25×3+0.5×2×0.04mol+672/22400mol==0.12mol。
答案:(1)c(HNO3)=4mol/L (2)Fe、Cu Cu (3)14.4 g
解析:(1)由第一组数据可知固体有剩余。无论硝酸和什么金属反应,都有n(HNO3)=4 n(NO)。加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,c(HNO3)=4mol/L。(2)由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.15 mol电子)。若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g。由此可知这9.2 g中应有Fe和Cu两种金属。所以第一次实验后剩余金属为Fe和Cu。第二次实验后剩余金属只有Cu。(3)由以上分析可知,第二次实验后剩余铜8 g,而与第一次相比少掉的9.2 g中Fe和Cu都有。设这9.2 g固体中Fe的物质的量为x mol和Cu的物质的量为y mol。
 56 x+64 y=9.2 ……(1)
56 x+64 y=9.2 ……(1)
2(x+y)=3×0.1……(2)
解得y=0.1 mol,质量是6.4 g。每次所取混合物中铜的质量6.4 g+8 g=14.4 g。
[当堂反馈]
18.在化工实验中,要除去某些杂质离子,往往采用在一定条件下使杂质离子以MxAy(DE4)z(OH)12的形式析出浅黄色晶体。M、A、D、E代表四种元素。已知:
①x+y+z=12(x、y、z均为正整数);
②取9.7克该化合物溶于水中,滴加用稀硝酸酸化的硝酸钡溶液,D、E两元素完全转化成白色沉淀。将沉淀过滤、洗涤、干燥称量其质量为9.32克;
③滤液中A、M以阳离子形式存在(未被硝酸氧化),用胶头滴管取滤液2-3滴于白色点滴板上,再加1-2滴硫氰化钾溶液,滤液变成红色;
④往滤液中通入足量的H2S气体,使A离子完全被还原后,得到0.96克浅黄色沉淀。
试分析:(1)D是__________,E是__________,理由_______________。
(2)A是__________,理由是______________________。
(3)通过计算和推理确定x=______、y=______、z=_______。该盐的化学式为__________。
17.A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙存在如下图所示的转化关系(转化过程都不需要使用催化剂)。
完成下列问题:
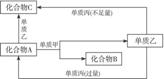
(1)若甲是常见金属,乙是常见非金属固体单质,A、C在常温下均为无色气体,且A、B、C、甲、乙、丙都由短周期元素组成,则B的电子式是__________。A与甲反应的化学方程式是__________________________。
(2)若上图所示的反应在水溶液中进行,甲在常温下为有色气体,乙在常温下为液体,丙是生活中常见的金属,则:
①丙在周期表中所处的位置是____________。
②丙与C反应的离子方程式为____________________。
③往A溶液中逐滴加入NaOH溶液时可能出现的现象是________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com