
13、(16分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH
 CH3COOC2H5+H2O
CH3COOC2H5+H2O
 请根据要求回答下列问题:
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)

①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
12、(18分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
 (1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g) + O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g) + O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A、升高温度 B、降低温度 C、增大压强
D、减小压强 E、加入催化剂 G、移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
11、(12分)“碘钟”实验中,3I- + S2O82- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= .
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A、<22.0s B、22.0~44.0s C、>44.0s D、数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
10、 右图是温度和压强对X + Y
右图是温度和压强对X + Y  2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气 体中Z的体积分数。下列叙述正确的是
( )
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气 体中Z的体积分数。下列叙述正确的是
( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
9、一定温度下,在恒容密闭容器中发生如下反应:2A(g)
+ B(g)  3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
( )
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
( )
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
8、已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
( )
A.通入稀有气体使压强增大,平衡将正向移动 B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小D.增加X的物质的量,Y的转化率降低
7、某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s);ΔH>0
Z(g)+W(s);ΔH>0
下列叙述正确的是 ( )
A.加入少量W,逆反应速率增大B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的ΔH增大
6、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
 下列描述正确的是 ( )
下列描述正确的是 ( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g)  Z(g)
Z(g)
5、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图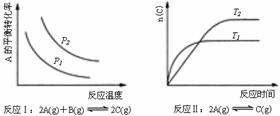 中P表示压强,T表示温度,n表示物质的量):
中P表示压强,T表示温度,n表示物质的量):
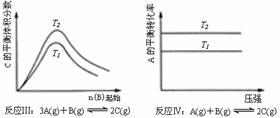 根据以上规律判断,下列结论正确的是
( )
根据以上规律判断,下列结论正确的是
( )
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
4、 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
( )
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
( )
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com