
18.等质量的三份铁a、b、c,分别加入足量的等量稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COOK。下列各图中 表示产生氢气总体积(V)与时间(t)的关系,其中可能正确的是 ( )
表示产生氢气总体积(V)与时间(t)的关系,其中可能正确的是 ( )
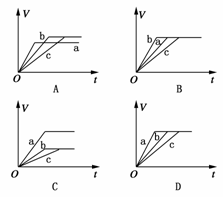
解析:铁与足量的稀H2SO4反应时,加入适量CuSO4溶液可形成铁铜原电池,加快铁与H2SO4的反应速率,但由于部分铁与CuSO4反应使得生成气体的量减少。加入适量CH3COOK,H2SO4与CH3COOK反应生成CH3COOH,CH3COOH为弱酸,使得铁与酸的反应速率减慢,由于酸过量,所以b和c产生的气体体积相等,A正确。
答案:A
第Ⅱ卷(非选择题,共46分)
17.(2009·山东英雄山中学高三第一学期期中测试)硒被称为主宰生命的元素之一,人们研究开发了一种含有钙、铁、锌、硒的保健品。对此下列对法正确的是 ( )
A.四种元素均处于第四周期,且均是主族元素
B.H2Se比H2O热稳定性好
C.单质钙能从FeSO4溶液中置换出铁
D.保健品为人体提供了必需的Fe、Zn、Se等微量元素
答案:D
16.下列反应的离子方程式正确的是 ( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2 :MnO2+2H++2Cl-Cl2↑+Mn2++H2O
:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
答案:B
15.下列化学反应中,水既不是氧化剂又不是还原剂的是 ( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.2F2+2H2O===4HF+O2
C.2Na+2H2O===2NaOH+H2↑
D.NaH+H2O===NaOH+H2↑
答案:A
14.(2009·东北师大附中模拟)如图B为常见金属或非金属单质,有下列转化关系:
→\x(B――→,\s\up7(O2
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是 ( )
A.NaCl B.AlCl3
C.H2O2 D.KCl
答案:A
13.将4 g铝铁合金粉末溶于足量盐酸中,加入过量氢氧化钠溶液,过 滤后向滤液中通入足量二氧化碳,再将沉淀滤出,经洗涤、干燥、灼烧后得到固体粉末的质量仍为4 g,原合金中铁的质量分数最接近 ( )
滤后向滤液中通入足量二氧化碳,再将沉淀滤出,经洗涤、干燥、灼烧后得到固体粉末的质量仍为4 g,原合金中铁的质量分数最接近 ( )
A.30% B.47%
C.53% D.70%
答案:B
12.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是 ( )
A.Al2(SO4)3 B.NaOH
C.BaCl2 D.FeSO4
解析:丁溶液滴入乙溶液中产生白色沉淀,继续滴加白色沉淀不断溶解并消失, 说明丁为NaOH,乙为Al2(SO4)3。将NaOH滴入甲溶液中无明显现象,说明甲为BaCl2,故丙为FeSO4。
说明丁为NaOH,乙为Al2(SO4)3。将NaOH滴入甲溶液中无明显现象,说明甲为BaCl2,故丙为FeSO4。
答案:D
11.(2009·安徽师大附中模拟)用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
①FeH2Cu
②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量 ( )
A.一样多 B.①多
C.②多 D.无法判断
解析:1 mol Fe按方案②能制得1 mol Cu,而1 mol Fe按方案①只能得到1 mol H2,而根据H2还原CuO的实验过程可知:制得1 mol Cu消耗H2的量大于1 mol,故方案①制得Cu的量少。
答案:C
10.铁和铁合金是生活中常用的材料,下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
解析:A项:铁合金中含有非金属元素C,B项:铁粉与水蒸气反应的方程式为3Fe+4H2O(g)Fe3O4+4H2,C项:铁形成合金后其化学性质不变,铁合金中的铁仍然能与盐酸发生反应,D项:镀锌铁板中金属Zn比Fe活泼,若发生电化学腐蚀,铁被保护,锌被腐蚀。
答案:B
9.向含有FeCl2、FeCl3、AlCl3、NH4Cl的混合溶液中先加入过量Na2O2固体,微热搅拌后再加入过量盐酸,溶液中阳离子数目变化最小的是 ( )
A.Fe2+ B.Fe3+
C.Al3+ D.NH
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com