
2.作者及课文背景知识的了解。
[教学难点]:古文字词的识记以及知识点的梳理和归纳。
[教学方法]:教授法,提问法
[课时安排]:1课时
[教学要点]:课文朗读,探讨关于课文作者的信息,教授生字,生词,归纳古文字词(第一自然段)。
[教学过程]:
㈠导入(5分钟)
⑴ 今天在上课的开 头我先请大家来听一首民歌,大家可以先闭上眼睛,一边欣赏音乐,一边勾勒出一副风景画,等到音乐结束。我要请同学来描述一下他的感受。
头我先请大家来听一首民歌,大家可以先闭上眼睛,一边欣赏音乐,一边勾勒出一副风景画,等到音乐结束。我要请同学来描述一下他的感受。
(音乐《梦入桃花源》,约2分钟)
⑵ 提问。请2-4个同学来描述一下他听完音乐的感受以及他脑海里所呈现的画面(2分20秒左右)
⑶ 小结辞:正如同学所说,音乐中所描述的桃花源是个令人是神往的地方,像一个美好的梦。相信大家对金庸笔下的“桃花岛”并不陌生,那里有美丽的景色,精致的楼台还有俏丽的黄蓉。那么关于桃源的美梦是谁最先开始做的呢?那就要追溯到很久很久以前了,有个叫陶渊明的东晋文人,他将自己的梦记录了下来 ,这就是我们今天的课文《桃花源记》。(35秒)
,这就是我们今天的课文《桃花源记》。(35秒)
㈡介绍作者和作品背景。(10分钟)
⑴提问:大家知道陶渊明吗?知道陶渊明的故事吗?他是怎样的一个人呢?(2-4分钟)
⑵ 关于作者陶渊明,书上只做了简单的介绍,他又名 潜,字元亮,别号五柳先生。东晋浔阳柴桑人,也是今天的九江市人。他的曾祖陶侃是东晋初名将,手握重兵,声威煊赫一时。死后追赠大司马。祖父陶茂官至太守,父亲也曾做过官。陶氏为东晋元勋之后,地位虽然不像当时的名门望族一样显赫,也是浔阳的大族。只是到了陶渊明这一代,因他年幼时父亲就去世了,家境便日渐败落。但他仍然属于士族阶层,大家要知道当时的士族是比较牛的,无论从生活上还是心态上都是高高在上的。陶渊明从二十九岁时开始出仕,任江州祭酒,但是他不如意,不久便归隐了。后陆续做过镇军参军、建威参军等地位不高的官职,过着时隐时仕的生活。当陶渊明四十一岁的时候,再次出来做彭泽县的县令,前后不过八十多天,便弃职而去,从此脱离了官场(为什么他辞职不干了呢?因为在他到任81天的时候浔阳郡派遣“邮至”,也就是相当于督察的这么一个官员来视察,有个小官告诉他要穿戴整齐迎接那位官员,他说“我岂能因为5斗米而向这么一个乡村小官点头哈腰的”,一气之下就辞职了。)也就是著名的“不为五斗米折腰”的故事。陶渊明辞官归里之后,小日子过得还算清闲。与夫人翟氏志同道合,安贫乐贱,“夫耕于前,妻锄于后”。并且他在家乡有自己的田庄和僮仆,开始一段期期,生活也算安宁自得。有时他也亲自参加一些农业劳动,作为自己的社会观和人生哲学的实践。在这种劳作生活中,与农民有所接近。后来由于农田不断受灾,房屋又被火烧,境况愈来愈恶化。但他始终不愿再为官求禄。
潜,字元亮,别号五柳先生。东晋浔阳柴桑人,也是今天的九江市人。他的曾祖陶侃是东晋初名将,手握重兵,声威煊赫一时。死后追赠大司马。祖父陶茂官至太守,父亲也曾做过官。陶氏为东晋元勋之后,地位虽然不像当时的名门望族一样显赫,也是浔阳的大族。只是到了陶渊明这一代,因他年幼时父亲就去世了,家境便日渐败落。但他仍然属于士族阶层,大家要知道当时的士族是比较牛的,无论从生活上还是心态上都是高高在上的。陶渊明从二十九岁时开始出仕,任江州祭酒,但是他不如意,不久便归隐了。后陆续做过镇军参军、建威参军等地位不高的官职,过着时隐时仕的生活。当陶渊明四十一岁的时候,再次出来做彭泽县的县令,前后不过八十多天,便弃职而去,从此脱离了官场(为什么他辞职不干了呢?因为在他到任81天的时候浔阳郡派遣“邮至”,也就是相当于督察的这么一个官员来视察,有个小官告诉他要穿戴整齐迎接那位官员,他说“我岂能因为5斗米而向这么一个乡村小官点头哈腰的”,一气之下就辞职了。)也就是著名的“不为五斗米折腰”的故事。陶渊明辞官归里之后,小日子过得还算清闲。与夫人翟氏志同道合,安贫乐贱,“夫耕于前,妻锄于后”。并且他在家乡有自己的田庄和僮仆,开始一段期期,生活也算安宁自得。有时他也亲自参加一些农业劳动,作为自己的社会观和人生哲学的实践。在这种劳作生活中,与农民有所接近。后来由于农田不断受灾,房屋又被火烧,境况愈来愈恶化。但他始终不愿再为官求禄。
陶渊明是中国士大夫精神上的一个归宿,许多士大夫在仕途上失意以后,或厌倦 了官场的时候,往往回归到陶渊明,从他身上寻找新的人生价值,并借以安慰自己。白居易、苏轼、陆游、辛弃疾等莫不如此。于是,不为五斗米折腰也就成了中国士大夫精神世界的一座堡垒,用以保护自己出处选择的自由。而平淡自然也就成了他们心目中高尚的艺术境地。
了官场的时候,往往回归到陶渊明,从他身上寻找新的人生价值,并借以安慰自己。白居易、苏轼、陆游、辛弃疾等莫不如此。于是,不为五斗米折腰也就成了中国士大夫精神世界的一座堡垒,用以保护自己出处选择的自由。而平淡自然也就成了他们心目中高尚的艺术境地。
陶渊明在中国文学史上,尤其 是中国的诗歌史上可以担得起“杰出”二字。
是中国的诗歌史上可以担得起“杰出”二字。
他的诗歌总的概括来分成三个部分,饮酒诗、咏怀诗和田园诗。而最出名的就是以田园生活为题材的,他开创了田园诗歌新的艺术境界,使田园诗歌在唐宋以后成为诗歌的重要内容。(陶诗沿袭魏晋诗歌的古朴伤风而进入更纯更熟的境地,他成功地将自然提升为一种美的至境,他创造了中国诗歌意境中一种新的,美的类 型,一种意韵极为醇厚而又朴实无华的冲淡美,这一切的取得与其丰富的人生体验分不开的,如果没有田园生活的体验也写不出这些广为传诵的田园诗,从而使陶诗在中国文学史上奠定了不朽的地位。)这位老先生喜欢喝喝酒,喜欢种种菊花,喜欢恬淡的隐居生活。但是他的作品却影响了唐宋元明清的后世文人,比如唐代的王维,孟浩然,他们继承和发扬了他的田园山水诗,比如宋代的苏轼,明代的朱熹都非常地推崇,用今天的话说就是崇拜陶渊明,将他视为自己的偶像。
型,一种意韵极为醇厚而又朴实无华的冲淡美,这一切的取得与其丰富的人生体验分不开的,如果没有田园生活的体验也写不出这些广为传诵的田园诗,从而使陶诗在中国文学史上奠定了不朽的地位。)这位老先生喜欢喝喝酒,喜欢种种菊花,喜欢恬淡的隐居生活。但是他的作品却影响了唐宋元明清的后世文人,比如唐代的王维,孟浩然,他们继承和发扬了他的田园山水诗,比如宋代的苏轼,明代的朱熹都非常地推崇,用今天的话说就是崇拜陶渊明,将他视为自己的偶像。
从当时的社会背景来是说,那是一个动乱的时代:宗室内部的斗争,军阀对政权的野心,不断引起血腥的杀戮乃至激烈的火并。这种社会动乱不仅给人民带来灾难,同时在社会上层也造成严重的不安全感。另一方面,在这种权力争夺之中,一切卑污血腥的阴谋,无不打着崇高道义的幌子。因此,陶渊明才会有逃避现实的思想,找个地方隐居。他向往的社会是和平安宁、自耕自食、无竞逐无虚伪、没有相互压迫和残害的社会;他追求的人生是淳朴真诚、淡泊高远、任运委化、无身外之求的人生;他所喜爱的生活环境,也是恬静而充满自然意趣的乡村。
(东晋时代那些专述老庄哲理的诗,被称为“玄言诗”,其最重要的代表,是孙绰和许询。然而,在东晋玄言诗中却又酝酿着一种新的重要的东西,这就是山水诗的萌芽。而且,陶渊明的田园诗,在某种意义上说来,也是山水诗的分支,与玄言诗同样有直接的关系。玄学本是超世的哲学,它强调人不仅在社会中存在,而且每一个人即每一个精神主体,都是直接面对宇宙存在的。因此人生的根本意义,也不在于世俗的荣辱毁誉、得失成败,而在于精神的超越升华,对世界对生命的彻底把握。宇宙的本体是玄虚的“道”,四时运转、万物兴衰是“道”的外现。从这种观念中引导出人对自然的体悟、追求,以及人与自然统一和谐的观念。加以江南山水,佳丽可人,对于来自北方的士大夫富有新鲜的刺激,更引起他们对山水自然的兴趣。由于玄风的影响,东晋散文除陶渊明外,别无名家。但王羲之的《兰亭序》,却可以说是一篇佳作。)
因此在这样的背景下,《桃花源记》就横空出世了,下面我们来对课文进行解读。
㈢课文基本知识 教授和翻译(20分钟)
教授和翻译(20分钟)
⑴ 播放课文朗诵FLSH(3分15秒)同时要求同学将生字注音。注意朗诵者的 断句要领。初步熟悉课文。
断句要领。初步熟悉课文。
⑵第一段翻译,重点字词的归纳。
晋太原中,武陵人捕鱼为业,(东晋太元年间,武陵郡有个人以打渔为生。注意太原是年号,该句交代了时间,主人公,以及他的职业。)
缘溪行,忘路之远近。((一天)他顺着溪水划船,忘记了路程的远近。缘:沿着。之: 的)
忽逢桃花林,夹岸数百步,(忽然遇到一片桃花林,生长在溪的两岸数量很繁多。注意:百步其实是一个大致的数量词,表示估计而已。)
中无杂树,芳草鲜美,落英缤纷,(中间没有别的树,花草鲜嫩而美丽,花儿纷纷都落下来。古今异义:鲜美:鲜艳美丽。今:味道好。杂:别的;缤纷:繁多的样子。)
渔人甚异之;复前行,欲穷其林。(渔人非常诧异,继续往前走,想走到林子的尽头。甚:很; 异:感到奇怪;之:语气助词;复:继续;前:向前;欲:想要;穷:形容词-动词 走完;其:指示代词,这,那 )
林尽水源,便得一山,(桃林的尽头正是溪水的发源地,便出现一座山。尽:到头)
山有小口,仿佛若有光。(山上有个小洞口,洞里仿佛有点光亮。仿佛:隐隐约约。)
便舍船,从口入。(渔人于是下了船,从洞口进去。省略句。舍:舍弃 )
初极狭,才通人。(起初,洞口很狭窄,只容一个人通过。省略句。才:仅仅)
复行数十步,豁然开朗。(又走了几十步,突然(变得)开阔敞亮了。复:继续。豁然开朗:形容由狭窄幽暗忽然变得宽阔明亮的样子。然:…的样子,豁(huò)然开朗)
土地平旷,屋舍俨然,((呈现在他眼前的是)一片平坦宽广的土地,一排排整齐的房 舍。然:…的样子。俨然:整齐的样子。俨(yǎn)然)
舍。然:…的样子。俨然:整齐的样子。俨(yǎn)然)
有良田美池桑竹之属。(有肥沃的田地、美丽的池沼、桑树、竹林之类。属: 类。)
阡陌交通,鸡犬相闻。(田间小路纵横交错,四通八达,(村落间)鸡鸣狗叫之声都处处可以听到。阡陌:田间的小路。交通:交错相通。 今:运输和邮电事业的总称,阡(qiān)陌)
其中往来种作,男女衣着,悉如外人。(人们在田野里来来往往,耕种 劳作,男女的穿戴跟桃源外面的人完全一样。其:这,那。悉:都)
劳作,男女的穿戴跟桃源外面的人完全一样。其:这,那。悉:都)
黄发垂髫,并怡然自乐。(老人和孩子们个个都安闲快乐。黄发:指老人。垂髫(tiáo):指儿童。髫,古代小孩的垂发。(指代) ,垂髫(tiáo))
读音: 豁(huò)然开朗 俨(yǎn)然 垂髫(tiáo) 阡(qiān)陌
字词翻译:
缘:沿着。
缤纷:繁多的样子。
甚:很
复:继续
欲:想要
尽:到头
仿佛:隐隐约约。
才:仅仅
豁然开朗:形容由狭窄幽暗忽然变得宽阔明亮的样子。
俨然:整齐的样子。
属: 类。
阡陌:田间的小路。
黄发:指老人。垂髫(tiáo):指儿童。髫,古代小孩的垂发。(指代)
古今异义:
鲜美:鲜艳美丽。今:味道好。
交通:交错相通。 今:运输和邮电事业的总称
词类活用:
才通人 通:使动用法 使人通过
欲穷其林 穷:形容词-动词 走完
渔人甚异之 异:形容词的意动用法 对...感到奇怪
复前行 前:名词-状语 向前
一词多义:
3. 要求复述课文基本内容,初步思考作品的含义。
[教学重点]:1.古文字词的掌握,课文的翻译。
2. 要求学生了解作者及课文的背景知识,明确作品的解读离不开作者,环境和文化背景。
1. 落实课文的朗读和古文字 词理解。进行古文基本知识的积累。
词理解。进行古文基本知识的积累。
附: 关于听力小结:
英语听力这门学科说来很有意思,因为学生分两种:一.听力好的 这种人就觉得听力不难,就这么莫名地提高了,题目做对了,貌似没有什么太大的难点;二.听力差的 这样的学生觉得听力老错,然后就是不知道怎么提高,背单词也没用,听听么好像懂的,题目做了就会错,不知道怎么提高。 其实首先要明白,听力主要还是靠practice的,没有什么神奇的方法能够帮你一夜之间成为听力能人!那么在训练的时候,注重相应的方法,可能会使得提高的效率更高而已。 听力提高的三要素: 1.词汇。不要傻乎乎的找本词汇手册就在那里背,完全脱离听力场景背单词并不可取。因为事实证明,很多人单词看到认识,但是听的时候就不知道了。这不是因为词汇量小,而是对词汇的把握没有达到一定的熟练程度!单词肯定是要背的,但是对于听力来说,可能背的单词还需用耳朵听一下。 2.坚持每天都听一定时间。听力这个东西提高很慢,但退步却很快。听一个星期可能没什么进步,但是一个星期不听却会有很大退步。这就为什么很多人如果听力不好,就一直很难提高的原因!所以每天花个1小时左右听,不仅提高听力,还会间接地提高口语的语音! 3.熟悉题型。毕竟是考试,所以熟悉题型,熟悉出题规律,当然能最大限度地发挥自身的听力能力。这方面一般报个培训班就好了。当然基础不错的同学,自学也是可以的。 总而言之,提高听力如果是为了通过考试做题的话。那么每篇至少听3遍。第一遍就是单纯地做题。第二遍是分析,不要看原文,不懂的地方多听几遍,然后再参考原文,不熟悉的词或词汇划出来背一下。第三遍是从头到尾再听一遍,捕捉更多的细节(not limited to the questions in the test)。
课后作业:
P5 问题与练习1、2、6、7
部分答案:1.ABC 2 BC 3 C 4 B 5、3×105 N/C 6×10-4 N
6、A
22.(12分)(2008·宁夏理综,26)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的 工艺流程,利用常用酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
工艺流程,利用常用酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
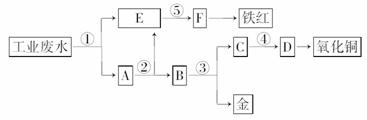
填写下面空白。
(1)图中标号处需加入的相应物质分别是①__________、②__________、③_ _________、④__________、⑤__________;
_________、④__________、⑤__________;
(2)写出①处发生反应的离子方程式__________________,写出③处发生反应的化学方程式____________________________;
(3)铁红的化学式为__________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红__________;氧化铜__________。
解析:本题主要考查了元素与化合物有关知识,通过对工业废水的处理,题目设计了高中 重要的元素Fe、Cu的有关性质内容,涉及内容主要有物质推断、化学用语、物质用途等。在解此题时宜采用逆向推断法,从题中给出信息可知,首先分离的应是铁元素,所加最佳试剂应是铁粉,E溶液就为Fe2+,铁红成分为Fe2O3,可联想到高中重要反应2Fe(OH)3Fe2O3+3H2O,试剂⑤应为可溶性碱(NaOH或氨水);当加入过量铁粉后,所得A应为固体Fe、Cu、Au的混合物,此时,只需加入稀硫酸(试剂②)后过滤可得Cu、Au混合物B,再加入稀硝酸试剂③可使Cu、Au得到分离,Cu(NO3)2加可溶性碱后加热得到CuO。
重要的元素Fe、Cu的有关性质内容,涉及内容主要有物质推断、化学用语、物质用途等。在解此题时宜采用逆向推断法,从题中给出信息可知,首先分离的应是铁元素,所加最佳试剂应是铁粉,E溶液就为Fe2+,铁红成分为Fe2O3,可联想到高中重要反应2Fe(OH)3Fe2O3+3H2O,试剂⑤应为可溶性碱(NaOH或氨水);当加入过量铁粉后,所得A应为固体Fe、Cu、Au的混合物,此时,只需加入稀硫酸(试剂②)后过滤可得Cu、Au混合物B,再加入稀硝酸试剂③可使Cu、Au得到分离,Cu(NO3)2加可溶性碱后加热得到CuO。
答案:(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+===Fe2++H2↑,2Fe3++Fe===3Fe2+
Cu2++Fe===Cu+Fe2+,2Au3++3Fe===2Au+3Fe2+
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
21.(16分)有一包含碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校课外学习小组在实验室做如下实验:
(1)第一组同学称取样品m g置于坩埚中加热至恒重,根据质量减少来计算其纯度。
①为完成测定,以下图示中还缺少的仪器名称是________。
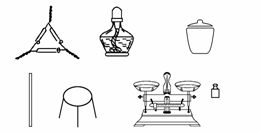
②为了减少实验误差,在加热至恒重的过程中应如何操作?
③若坩埚质量为m0。恒重后坩埚和残留物质量为m2 g,则计算碳酸氢钠样品纯度的计算式为w(NaHCO3)=________×100%。
(2)第二组同学称取样品m g,设计了如下图所示的装置:

①装置中导管a的作用是___________________________________________
______________________________________________________________________。
②实验结束时,该组同学在测量实验中生成气体体积时应注意哪些问题?
③第二组同学在实验中准确测得3个数据:实验前样品的质量m g,实验前后量液管中液面读数分别为V1 mL、V2 mL,由于欲计算碳酸氢钠样品纯度时发现少了一个必须的物理量是________。
(3)分析上述两组实验方案,你认为哪组实验方案的误差会小些?为什么?
(4)请你设计一种除上述实验原理以外的方案,写出反应方程式并简述实验步骤。
解析:第一组同学利用碳酸氢钠受热易分解而碳酸钠受热不易分解的性质进行实验,灼烧样品所需的坩埚在取用时要用坩埚钳,为了减少实验误差,需要把灼烧后的样品放在干燥器中干燥;根据差量法即可求出碳酸氢钠的质量分数。第二组同学的实验依据碳酸钠和碳酸氢钠都和稀盐酸反应放出二氧化碳气体,通过气体的体积和样品的质量求碳酸氢钠的质量分数,因为实验环节少,所以误差也小。
答案:(1)①坩埚钳、干燥器
②加热后,放干燥器中冷却至室温后称置。重复操作,直到两次称量的质 量差小于0.1 g。
量差小于0.1 g。
③×100%
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,使分液漏斗中的稀盐酸能顺利滴下;滴入锥形瓶的稀盐酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀盐酸引起的二氧化碳气体体积误差
②待实 验装置冷却后,上下移动量液管,使其中液面与广口瓶中液面相平;再将视线与量液管内的凹液面最低处相平来读取液体体积,即得到CO2在该状况时的体积。
验装置冷却后,上下移动量液管,使其中液面与广口瓶中液面相平;再将视线与量液管内的凹液面最低处相平来读取液体体积,即得到CO2在该状况时的体积。
③该条件下的气体摩尔体积
(3)第二组较好。实验系统中样品损耗几率低、反应转化率高;用精密测量仪器测定的数据误差较小。
(4)如沉淀法 BaCl2+Na2CO3===BaCO3↓+2BaCl2
步聚:取样称量、溶解、沉淀、过滤、洗涤、干燥、称量、计算。(其他合理方法也可,如滴定法等)
20.(10分)(2009·江苏)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保持理念的是________(填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g);
ΔH=64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g);ΔH=-196.46 kJ·mol-1
H2(g)+O2(g)===H2O(l);ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为________________________________________________________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因 是________________________________________________________________________
________________________________________________________________________。
(4)在提纯后CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是__________________________________________
______________________________________________________________________。
解析:溶解Cu的化学方程式:Cu+2H++H2O2===Cu2++2H2O,由盖斯定律可得Cu(s)+2H+(aq)+H2O2(l)===Cu2+(aq)+2H2O(l);ΔH=64.39 kJ·mol-1+(-196.46 kJ·mol-1×)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1,第(3)问中Cu的溶解速率在温度较高时随温度升高,其溶解速率反而减小,主要原因是温度偏高时,H2O2分解速率加快而导致H2O2浓度变小影响反应速率;第(4)问中Cu元素由+2价变化至+1价,是利用了SO的还原性。
答案:(1)B、D
(2)Cu(s)+2H+(aq)+H2O2(l)===Cu2+(aq)+2H2O(l);
ΔH=-319.68 kJ·mol-1
(3)H2O2的分解速率加快
(4)2Cu2++SO+2Cl-+H2O2CuCl↓+SO+2H+
19.(8分)(2009·巢湖模拟)如图A-J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
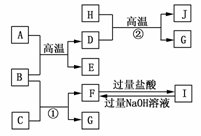
根据图示回答问题:
(1)写出下列物质的化学式:A________,B________,E________,I________;
(2)反应①的离子方程式是____________________________;
反应②的化学方程式是________________________________;
(3)J与盐酸反应的化学方程式是____________________________;
反应后的溶液与D反应的离子方程式是___________________________________。
解析:B为地壳中含量最高的金属元素,故B为Al。
由单质铝+B单质D+E可知该反应为铝热反应;
则A为Fe2O3,D为Fe,E为Al2O3。
根据铁与无色液体(H2O)在高温下反应可生成气体G和磁性材料J知该反应方程式表示为:
3Fe+4H2O(g)Fe3O4+4H2
即J为Fe3O4,G为H2。
由反应①及F与I的转化条件判断,C为强碱溶液,
F为NaAlO2,I为AlCl3。
答案:(1)Fe2O3 Al Al2O3 AlCl3
(2)2Al+2OH-+2H2O===2AlO+3H2↑
3Fe+4H2O(g)Fe3O4+4H2
(3)Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
2 Fe3++Fe===3Fe2+
Fe3++Fe===3Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com