
11.已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH1=-Q1,H2(g)+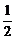 O2(g)===H2O(g);ΔH2=-Q2,H2(g)+
O2(g)===H2O(g);ΔH2=-Q2,H2(g)+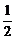 O2(g)===H2O(l);ΔH3=-Q3,常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为
( )
O2(g)===H2O(l);ΔH3=-Q3,常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为
( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
10.在一定条件下将1mol的CO和2mol H2O(g)放入密闭容器中发生反应:
CO(g)+H2O(g)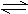 CO2(g)+H2(g),达到平衡时测得CO2为 0.6mol,再通入4mol H2O(g),达到平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为 0.6mol,再通入4mol H2O(g),达到平衡后,CO2的物质的量为
A、0.6mol B、1mol C、大于0.6mol D、大于1mol
9.一定条件下向一带活塞的密闭容器中充入2molSO2和1molO2,发生如下反应:
2SO2(g) +O2(g) 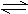 2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是( )
2SO3(g)达平衡后改变下列条件,SO3气体的平衡浓度不改变的是( )
A、保持温度和容器的体积不变,充入1molSO2(g)
B、保持温度和容器内压强不变,充入1molAr(g)
C、保持温度和容器内压强不变,充入1molO2(g)
D、保持温度和容器内压强不变,充入1molSO3(g)
8.下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
7.同温同压下,下列各组热化学方程式中,△H1<△H2的是( )
A.C(s)+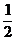 O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
B.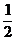 H2(g)+
H2(g)+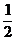 Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
D.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
6.对于反应A2+3B2=2AB3来说,在其反应速率的表示中,速率最快的是( )
A.无法比较 B.V(B)=0.6 mol/(L·min)
C.V(AB3)=0.5 mol/(L·min) D.V(A)=0.4mol/(L·min)
5.在一个绝热的体积一定的密闭容器中发生可逆反应:
N2(g) + 3H2(g) 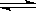 2NH3(g) ; △H<0
2NH3(g) ; △H<0
下列各项中不能说明该反应已经达到平衡状态的是 ( ) A.体系的压强不再改变 B.体系的温度不再改变 C.断裂1mol N≡N键的同时,也断裂6molN-H键 D.反应消耗的 、与产生的的速率υ() : υ() : υ() == 1∶3 ∶2
4.1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的( )
A. 2H2(g)+O2(g)=2H2O(l) ; ΔH=-142.9kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ; ΔH=-571.6kJ·mol-1
C. 2H2+O2=2H2O ; ΔH=-571.6kJ·mol-1
D. H2(g)+1/2O2(g)=H2O(g) ; ΔH=-285.8kJ·mol-1
3.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是( )
A.加热 B.将稀硫酸改为98%的浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
2.已知反应A+3B==2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L·min),则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol/(L·min) B.1 mol/(L·min)
C.2 mol/(L·min) D.3 mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com