
被检液中滴入少量 酸化,再加入 ,若产生 ,不可用硝酸酸化,原因是 。
试题枚举
[例1]高温下硫酸亚铁发生如下反应:2FeSO4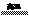 Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是 ( )
Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是 ( )
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
解析:SO2和SO3通入氯化钡溶液,只有硫酸钡沉淀,因为亚硫酸钡溶于稀硫酸
答案:D
[例2]白色的亚铜化合的Cu(NH4)SO3难溶于水,若与足量的10mol·L-1的硫酸溶
液混合并微热,生成铜和SO2气体及溶液。
(1)完成并配平化学方程式:Cu(NH4)SO3+H2SO4-Cu+SO2+CuSO4+_________
(2)按上述操作,铜的最高转化率是多少_______________
(3)有人设计让上述实验在密闭容器中进行,结果铜的转化率大大提高,问在密闭
容器中进行反应,铜的最高转化率是多少?请说明理由。
解析:(1)上述反应打用逆向配平(歧化反应,铜元素化合价既升高又降低)缺项显然为(NH4)2SO4 ,各计量系数依次为2,2,1,2,1,2,1。
(2)2molCu (NH4)SO3中的铜1mol转化为单质铜,1mol转化为CuSO4,因此,转化率为50%。
(3)若在密闭容器中进行,为何铜的转化率会提高?显然Cu(I)自身岐化转化率只能为50%,必有其它还原剂才能提高其转化率。由于产物中含SO2,SO2具有强还原性,能将Cu(II)还原为零价。其最高转化率可达100%,原因是:每生成1molCuSO4可生成2molSO2,它可提供4mol电子,完全可将CuSO4还原且SO2仍过量。
答案:(1) 2,2,1,2,1,2,1 (2) 50% (3)略
[例3]硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得Sz2-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与Sz2-也完全转化为S2O32-。问:
(1)S+SO2+OH-完全转化为S2O32-的离子方程式____________________
(2)amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
(3)若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
_________。
 解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①
解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①

 S2-+(x+1)S Sx2- ………………②
S2-+(x+1)S Sx2- ………………②
SO32-+S △ S2O32- ……………………③
由①②③迭加得:(2x+2)S+6OH- = 2Sx2-+S2O32-+3H2O …………④
SO2+Sx2-+OH---S2O32-+H2O ………………⑤
由④⑤迭加得:S+SO2+2OH-=S2O32-+H2O …………………………⑥
答第(1)问时,实质不必要这么繁的过程,因Sx2-、SO32-均为中间产物,只要抓住反应物为S和SO2及OH-,生成物为S2O32-和水即可得反应⑥。
由⑥式可知每有1mol硫需1molSO2和2molOH-,则SO2和OH-分别为a、2amol。
(3)由④式可知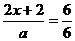 x=
x=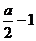
答案:(1) S+SO2+2OH-=S2O32-+H2O (2) a、2amol (3) 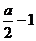
浓硫酸除了具有酸的通性外,还具有吸水性、脱水性和强氧化性这三大特性。
(1) 吸水性:吸收游离的水。可作实验室的干燥剂(但不能干燥碱性气体和还原性气体)。
(2) 脱水性:把有机物中的氢、氧两种元素按水的比例脱去。如蔗糖中加入浓硫酸(注意吸水和脱水的区别)。
(3) 强氧化性:浓硫酸的强氧化性还可以与多种物质反应体现。
2H2SO4(浓)+Cu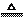 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
2H2SO4(浓)+C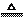 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
在常温下,浓硫酸跟铁、铝接触时,能在金属表面生成一薄层致密的氧化物,从而阻止内部的金属继续反应,这种现象叫钝化。因此可以用铁或铝贮存浓硫酸(硝酸也具有这一性质)。但是加热条件下可以反应。注意:常温下铁、铝使浓硫酸、浓硝酸钝化(钝化过程是复杂的化学变化),不能理解成“常温下铁、铝使浓硫酸、浓硝酸不发生化学反应”。
4.SO2的危害和治理
SO2是大气主要污染物,直接危害人类身体健康,酸雨为SO2产生的二次污染物。SO2的主要来源为燃烧含硫的燃料(如煤),消除SO2污染的最有效的途径是减少SO2的排放。
SO3是硫的最高价氧化物,为白色易挥发晶体,是典型的酸性氧化物
3. SO2的实验室制法:
|
反应原理 |
Na2SO3+ H2SO4==
Na2SO4+ SO2↑+H2O(可加热提高反应速率) Cu+ 2H2SO4 (浓) 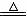 CuSO4+ SO2↑+2H2O CuSO4+ SO2↑+2H2O |
|
发生装置 |
固体与液体反应制取气体,发生装置与制Cl2相似 |
|
收集方法 |
向上排空气法 |
|
干燥 |
用浓H2SO4或P2O5酸性干燥剂(不可用碱石灰) |
|
尾气处理 |
用NaOH等碱溶液吸收多余的二氧化硫气体 |
2.SO2的化学性质:(1)具有酸性氧化物的通性:
(2)具有还原性:
(3)具有氧化性 其氧化性比氧气,氯气都弱。
(4)具有漂白性:漂白原理是 和HClO的漂白性的区别 。
★几种物质漂白原理的比较
|
|
SO2 |
氯水、H2O2、Na2O2、O3 |
活性炭 |
|
漂白原理 |
与有色物质结合生成无色物质 |
将有色物质氧化为无色物质 |
吸附有色物质 |
|
变化类型 |
化学变化 |
化学变化 |
物理变化 |
|
是否可逆 |
可逆,加热或日久后恢复原来颜色 |
不可逆,加热或日久后不恢复原来颜色 |
|
1.SO2的物理性质: 色有 气味 体, 毒 溶于水。
3.硫与氢气化合生成 ,生成的氢化物比水 (“稳定”还是“不稳定”)
2.汞与硫磺生成硫化汞,因此,实验室常将硫磺撒在汞的表面,以除去不慎洒落的汞。化学方程式为 ,硫的的化合价 (填“升高或降低”)
1.硫的可燃性:硫在纯净的氧气中燃烧现象 ,硫的化合价- (填“升高或降低”)
硫位于周期表 周期 族。淡黄色晶体,难溶于水,微溶于酒精,能溶于 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com