
11、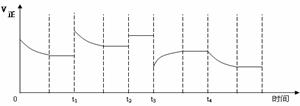 (2008-2009学年度启东市汇龙中学第一次月考)合成氨反应:N2(g)
+ 3H2(g)
(2008-2009学年度启东市汇龙中学第一次月考)合成氨反应:N2(g)
+ 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
下列说法正确的是[BC ]
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时减小了压强
D.t4时降低了温度
10.(常州一中2009届12月高三化学月考)在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生: ① IO3-+ 5I-+ 6H+ → 3I2 + 3H2O ② I2 + 2HSO3-+ H2O → 2I- + 2SO42-+ 4H+
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是[C ]
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关
9. (淮阳一高09高三一轮复习月考(11月份) 对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是:[ B]
(淮阳一高09高三一轮复习月考(11月份) 对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是:[ B]
A 、
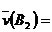 0.8mol·L-1·s-1 B、
0.8mol·L-1·s-1 B、 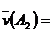 0.4mol·L-1·s-1
0.4mol·L-1·s-1
C、 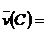 0.6mol·L-1·s-1 D、
0.6mol·L-1·s-1 D、 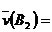 42mol·L-1·min-1
42mol·L-1·min-1
8.[江苏省前黄高级中学国际分校09届第一学期期末综合练习二]I、在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是 (填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为 。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W D.2 molX、1mol Y、1molZ
(5) X的转化率α= (用含Q、Q1的代数式表示)。
II、二氧化碳作为一种温室气体,世界各国都在限制其排放量,同时科学家也加强了对CO2创新利用的研究。
回答下列问题:
⑴ 目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于 ▲ 。
⑵ 最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把二氧化碳从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇等。“绿色自由”构想技术流程如下:
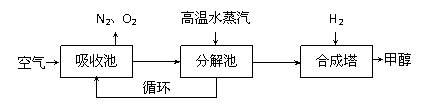
① 吸收池中盛有饱和碳酸钾溶液。分解池中反应的化学方程式为 ▲ 。
② 在合成塔(条件:2×105Pa、300℃、铬锌触媒)中,若有4.4kg CO2与足量H2恰好完全反应,放出4947kJ的热量,写出合成塔中发生反应的热化学方程式 ▲ 。
⑶ 利用CO2催化氢化制甲烷的研究过程如下:
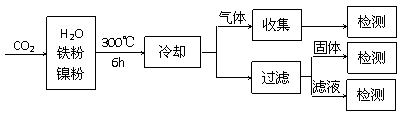
反应结束后,气体中检测到CH4和X,滤液中检测到HCOOH,固体中检测到镍粉和Y。实验表明,HCOOH是CO2转化为CH4的中间体:CO2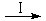 HCOOH
HCOOH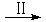 CH4。当其他条件不变,仅改变镍粉用量时,CH4、HCOOH、X的产量和镍粉用量的关系如下表所示:
CH4。当其他条件不变,仅改变镍粉用量时,CH4、HCOOH、X的产量和镍粉用量的关系如下表所示:
|
镍粉用量 |
1mmol |
5mmol |
10mmol |
15mmol |
20mmol |
|
甲烷产量 |
2mmol |
11mmol |
15mmol |
11mmol |
7mmol |
|
X 产 量 |
27mmol |
3.5mmol |
0.8mmol |
0.2mmol |
0.01mmol |
|
甲酸产量 |
17mmol |
3mmol |
1.5mmol |
0.8mmol |
0.2mmol |
① X、Y的化学式分别为 ▲ 、 ▲ 。
② 镍粉的作用是 ▲ 。
③ 当镍粉用量从10mmol增加到20mmol时,甲烷产量降低的原因是 ▲ 。
答案. (1) 减小 (2分) (2) 1 (2分)
(3) 正确(1分) 2 molX和1 molY不可能完全反应 (1分)  w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
(4)
A (2分,有错不给分)
(5) 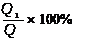 (2分)
(2分)
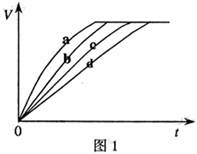
7.[江苏省前中国际分校2009届高三第一学期第一次调研试卷]等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是[ D ]  w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
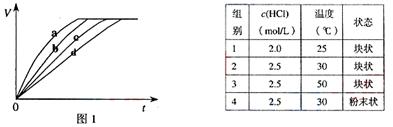
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
6.[江苏省前中国际分校2009届高三第一学期第一次调研试卷]某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是[ BD]w.w.w.k.s.5.u. c.o.m
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是[ BD]w.w.w.k.s.5.u. c.o.m
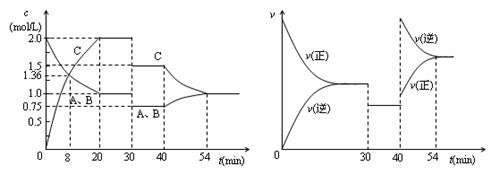
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为4
5.[09届江苏省前黄高级中学国际分校期末化学综合练习四]下列实验不能达到预期目的的是 ( )
A.锌与稀硫酸反应制取氢气时,加入少量硫酸铜溶液以加快其反应速率
B.用蒸馏的方法将海水淡化以解决人类饮用水的危机
C.以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱:盐酸>碳酸>苯酚
D.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液,加热后用硫酸酸化,再滴加硝酸银
4.[江苏省泗阳中学2009届高三第一次摸底考试](10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)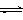 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
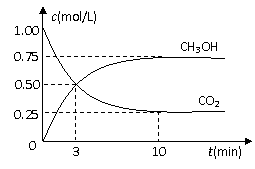
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
答案. ⑴①0.225 ② ③C、D
⑵ 2CO2+4e―+2H2O=2 CO+4OH―
不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行 (每空2分,共10分)
2.
 [江苏省常州市第三中学2009届高三化学11月模拟试卷. ]在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法不正确的是[A]
[江苏省常州市第三中学2009届高三化学11月模拟试卷. ]在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法不正确的是[A]
A.2min时,M的物质的量浓度为0.6mol·L-1
B.4min时,用M表示的反应速率为0.2mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量不变
D.4min时,M的转化率为80%
|
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
1.[ 江苏省武进高级中学2009届高三模拟化学试题]工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( D )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com