
18.(16分)由短周期元素组成的10种物质A-J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
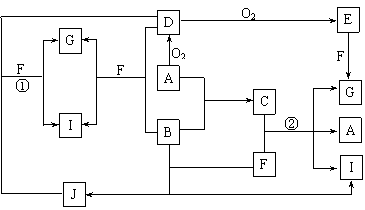
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
17.(14分)工业生产粗硅的主要原理为:SiO2 + 2C 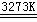 Si(粗)
+2CO↑
Si(粗)
+2CO↑
⑴若在制粗硅的过程中同时生成了碳化硅,且二者物质的量之比为1∶1,则参加反应的C和SiO2的质量比为 。
⑵工业上可通过以下原理由粗硅进一步制纯硅:
Si(粗)
+ 2Cl2(g) 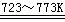 SiCl4(l) SiCl4 + 2H2
SiCl4(l) SiCl4 + 2H2
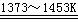 Si(纯)
+ 4HCl
Si(纯)
+ 4HCl
若上述反应中Si(粗) 和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂多少吨?
16.(18分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为 ;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
……
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有 。
15.(16分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
⑴图一可通过观察 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
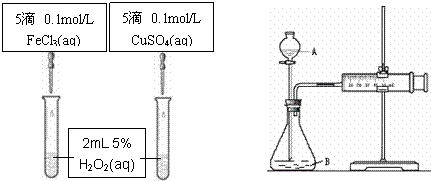
图一 图二
⑵检查图二装置气密性的方法是
。图二所示实验中需测量的数据是 。
14.某研究小组研究了其他条件不变时,改变条件对以下可逆反应的影响:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
下列说法正确的是
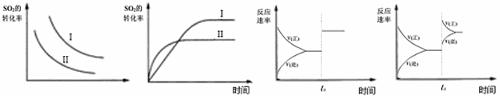
图一 图二 图三 图四
A.图一研究的是温度、压强对平衡的影响,横坐标表示压强
B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高
C.图三中t0时使用了催化剂,使平衡向正反应方向进行
D.图四中t0时增大压强,使平衡向正反应方向进行
13.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中c(NH4+):①<②<③
D.相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
12. 一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是
一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-= H2O2+2H+
11.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均减小B.温度下降10℃,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等D.用同浓度的盐酸中和,消耗的盐酸体积相同
10.按照下列有关方法进行实验,实验结果偏大的是
A.测定硫酸铜晶体中结晶水含量,失水后的硫酸铜置于空气中冷却后再测质量
B.测定中和热实验中,所使用的稀NaOH溶液的物质的量稍大于稀盐酸
C.配制一定物质的量浓度的溶液实验中,容量瓶内壁附有蒸馏水
D.用标准盐酸滴定未知浓度的氢氧化钠溶液,开始时俯视读数,终点时仰视读数
9.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com