
5.在体积不变的容器中,2NH3 3H2+N2达到平衡时,NH3的转化率为50%,此时平衡混合气的密度与NH3未分解时的密度之比为………………………………………………………………………………(
)
3H2+N2达到平衡时,NH3的转化率为50%,此时平衡混合气的密度与NH3未分解时的密度之比为………………………………………………………………………………(
)
A.1:1 B.2:3 C.3:2 D.2:1
4.在一定温度和压强下,在密闭容器中充入H2、N2、NH3,开始时其物质的量之比为3:1:1,反应达平衡后,H2、N2、NH3的物质的量之比为9:3:4,则此时N2的转化率为……………………………( )
A.10% B.20% C.15% D.30%
3.合成氨所需的H2由炭和水蒸气反应制得,其中一步反应为CO+H2O(g) CO2+H2 △H<0,欲使CO的转化率提高,同时提高H2的产率,可以采取的措施是……………………………………………(
)
CO2+H2 △H<0,欲使CO的转化率提高,同时提高H2的产率,可以采取的措施是……………………………………………(
)
A.增大水蒸气的浓度 B.升高温度 C.增大CO浓度 D.增大压强
2.在一定条件下,可逆反应N2+3H2 2NH3 △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是………………………………………………………………………………………………………(
)
2NH3 △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是………………………………………………………………………………………………………(
)
A.加入催化剂V正、V逆都发生变化,且变化的倍数相等
B.加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数
C.降温,V正、V逆都减小,且V正减少倍数小于V逆减少倍数
D.体积不变加入氩气,V正、V逆都增且V正增大倍数大于V逆增大倍数
1.对于合成氨工业,只从提高原料转化率看,从下列条件中选择最适宜的组合是……………………………………………………………………………………………………………( )
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨
A.②④⑤ B.②④⑦ C.①④⑤ D.②③⑥
9.在一定温度下,向一个2L的真空密闭容器中事先装入催化剂,通入1molN2和3molH2,经过一段时间后,测得容器内压强为反应起始的0.9倍,在此时间内以H2表示的平均速率为0.1mol•L-1•min-1,则所经过的时间是多少?
[课堂小结]
[课后作业]
8.有密闭容器A和B,A保持恒压,B保持恒容,起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2与O2,发生2SO2+O2 2SO3的反应,并达到平衡,则(填>、=、<,逆、正或不变)
2SO3的反应,并达到平衡,则(填>、=、<,逆、正或不变)
(1)SO2的转化率α(A)____ α(B)
(2)起始时两容器的反应速率v(A)___v(B),反应过程中反应速率v(A)___v(B)
(3)达到平衡时,分别通入等量的Ar气,A中平衡向____反应方向移动,B中的化学反应速率____
7.下列事实不能用勒夏特列原理解释的是…………………………………………………………( )
A.对盛在烧杯里的氨水加热,氨水中NH4+浓度减小
B.对熟石灰的悬浊液加热使温度升高,悬浊液中Ca(OH)2固体的含量增加
C.高压有利于合成氨的反应
D.500℃比室温更有利于合成氨的反应
6.用焦炭、空气、水为原料制备NH3,则参加反应的焦炭与产品之间的物质的量之比为………( )
A.3:4 B.3:2 C.2:3 D.1:2
5.有平衡体系CO(g)+2H2(g)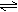 CH3OH(g) △H<0 为了增加甲醇的产量,应采取的正确措施为……………………………………………………………………………………………………………(
)
CH3OH(g) △H<0 为了增加甲醇的产量,应采取的正确措施为……………………………………………………………………………………………………………(
)
A.高温 B.适宜的温度、高压、催化剂
C.低温、低压 D.高温、高压、催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com