
14.在400℃,1.01X105Pa时,将SO2和14molO2 压入一个装有催化剂的VL密闭反应器中,发生2SO2+O2 2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2:
2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2:
(1)SO2的起始浓度为_______,SO3(气)的平衡浓度为_________;
(2)SO2的转化率为________,O2的平均反应速率为________;
(3)平衡时SO3(气)占总体积的百分数为__________,此时体系压强为反应起始时体系压强的________倍;
(4)达平衡后再加入2molSO2、12molO2和4molSO3(气),此时正反应速率将_______,逆反应速率将_ ______,平衡___ ____移动。
13.合成氨反应,在一定条件下密闭容器中加入a molN2,b molH2,达到平衡时生成c molNH3,则消耗N2的物质的量为______,消耗H2的物质的量为_______,N2的转化率为_______,若反应过程中保持恒定体积,恒定温度,则平衡容器内压强是原压强的______倍,容器中剩余N2的物质的量为______mol。
12.在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2 2NH3 △H<0
2NH3 △H<0
(1)当反应达到平衡时,N2和H2的浓度比是______。
(2)保持体积不变,升高温度时,混合气体的平均式量_____,密度_____。
(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将_______移动。
(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将______移动。
(5)当达到平衡时,充入N2并保持压强不变,平衡将________移动。
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将____移动。
11.已知N2(g)+3H2(g)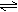 2NH3(g),2SO2(g)+O2(g)
2NH3(g),2SO2(g)+O2(g)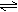 2SO3(g)。这两个反应的正反应都是放热反应。回答下列问题:
2SO3(g)。这两个反应的正反应都是放热反应。回答下列问题:
(1)从影响速率和平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施都是_______________________________________________,实际生产中采取的措施分别是________________________。
(2)在实际生产合成氨过程中,要分离出氨气,其目的是________________________;而合成SO3过程中,不需要高压,原因是______________________________。
(3)工业生产硫酸用 处理尾气。
10.在一密闭容器中,用等物质的量的A和B发生如下反应:
A(气)+2B(气)  2C(气)反应达到平衡时。若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为…………………………………………………………………………………(
)
2C(气)反应达到平衡时。若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为…………………………………………………………………………………(
)
A .70% B.40% C.50% D.60%
9.下列所述情况表示合成氨反应达到平衡状态的是………………………………………………( )
A.H2的消耗速率与NH3的生成速率之比为3:2
B.混合气体的平均相对分子质量不再改变
C.N2的生成速率与NH3的消耗速率之比为1:2
D.密闭容器中H2、N2、NH3的物质的量之比为3:1:2
8.工业合成氨反应是700K左右进行的,这主要原因是……………………………………………( )
A.700K时此反应速率最快 B.700K时氨的平衡浓度最大
C.700K时氨的转化率最高 D.700K该反应的催化剂能发挥最大的作用
7.在一定条件下,进入氨合成塔的混合气体中含N2的体积分数为22%,含H2的体积分数为78%,经过合成反应达到平衡后,在相同的温度和压强下,气体的体积缩小至原体积的95%,N2的转化率与下面接近的数值是……………………………………………………………………………………………………( )
A.12.5% B.11.4% C.10.5% D.9%
6.在密闭容器中进行如下反应已达平衡,N2+3H2 2NH3 △H<0,其他条件不变时,若将平衡混合物中各物质的浓度都增大到原来的2倍,则下列说法中正确的是……………………………………( )
2NH3 △H<0,其他条件不变时,若将平衡混合物中各物质的浓度都增大到原来的2倍,则下列说法中正确的是……………………………………( )
A.平衡不移动 B.平衡向正方向移动
C.平衡向逆反应方向移动 D.再次达到平衡时NH3的百分含量不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com