
1.下面四个有关数量积的关系式:
①0·0=0,②(a·b)·c=a·(b·c),③a·b=b·a,④|a·b|≤a·b.
其中正确的是
A.①② B.②③ C.③④ D.①③
15. 下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期半径最小的金属元素组成的单质,K是一种红棕色气体。

请填写下列空白:
(1)A的化学式为 ,I的原子结构示意图为 。
(2)在周期表中,组成单质G的元素在周期表中的位置是___________________________。
(3)写出反应⑦的化学方程式 。当有0.3 mol电子转移时,生成G的物质的量为 。
(4)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是____________(填写序号)。
(5)反应④的离子方程式是:____________________________________________

(6)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:

答案(1)SO2 

(2)第四周期第Ⅷ族
(3)2Al+Fe2O3 Al2O3+2Fe 0.1 mol
Al2O3+2Fe 0.1 mol
(4) ③
(5) 3Fe2++ +4H+ = 3Fe3++NO↑+2H2O
+4H+ = 3Fe3++NO↑+2H2O
(6) Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O

14. 铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
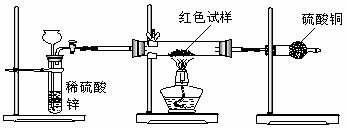
(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号)
①通入氢气体积;②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
 (5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由
答案(1)方案Ⅰ不合理,铜和氧化亚铜都能和硝酸生成Cu2+;方案Ⅱ不合理,Cu+在酸性条件下能发生自身氧化还原反应,也生成了铜单质 
(2)c= (10b-a)
(3)关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置的漏气
(4)②③⑤
(5)需要
反应后,应让铜粉在氢气流中冷却,如没有干燥管,铜粉将吸湿。
13. 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有
。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是 。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
 (4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是
。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是
。
答案
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O,2Fe3+ + Fe = 3Fe2+,Fe + 2H+ = Fe2+ + H2↑
(2)C或CO, 2 CuO+C==2Cu+CO2↑
(3)2Cu+O2+2H2SO4==2CuSO4+2H2O
或2Cu + O2== 2CuO , CuO + H2SO4 == CuSO4 + H2O
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2
12. 铜、铁、锌等质量组成的合金W g,加入到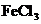 和盐酸的混合液中,充分反应后:
和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有_______ _,还可能有_____ ___.
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有________,可能还有_____ ___.
(3)若剩余固体为 ,则溶液中的阳离子一定有______ __,一定没有_____ ___.
,则溶液中的阳离子一定有______ __,一定没有_____ ___.
解答:
(1)电子氧化性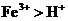 ,而Cu、Fe、Zn全部液解,故一定有
,而Cu、Fe、Zn全部液解,故一定有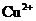 、
、 、
、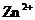 ,可能还有
,可能还有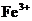 、
、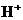
(2)根据氧化还原反应进行的次序规律,因还原性Zn>Fe>Cu,若剩余固体W/3克时,则为Cu,又因为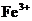 与Cu反应,
与Cu反应,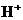 与Cu不反应,故一定有
与Cu不反应,故一定有 、
、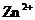 ,可能还有
,可能还有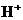 ,一定没有
,一定没有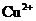 、
、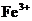
(3)剩余固体为Cu、Fe、Zn,只有部分Zn溶解,加之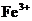 、
、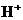 、
、 均要与Fe反应,故一定有
均要与Fe反应,故一定有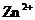 ,一定没有
,一定没有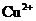 、
、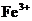 、
、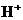 、
、
11. (江苏省前黄高级中学09届上学期高三化学第二次周练卷 )铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是 。
 [实验步骤]
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积
105Pa)的体积
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:
 ①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
 A.待实验装置冷却后再读数
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是 。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。
答案.[方案一]2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (1)97mL (2)偏高
[方案二](1)①EDG
 ②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
③ACD
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
③ACD
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。 ②V1-V2
10. (广东省佛山市禅城实验高中2009届高三第二次月考)某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案: ( )

方案I:铜铝混合物 测定生成气体的体积

方案II:铜铝混合物 测定剩余固体的质量
下列有关判断中不正确的是: ( )
A. 溶液A和B均可以是盐酸或NaOH溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用浓硝酸,则测得铜的质量分数偏小
D. 实验室方案II更便于实施
答案:B
9. 2006年11月23日中科院网报道,核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
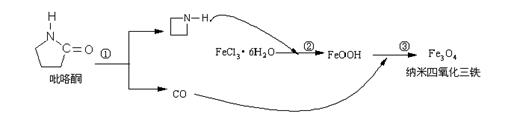
下列有关叙述不合理的是
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
答案:B
8. 制印刷电路时常用氯化铁作腐蚀液,有关反应为2FeCl3 + Cu =2FeCl2 + CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中不可能出现的是 ( )
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
 答案:B
答案:B
7. 将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈血红色的是 ( )
A.Fe2O3 B.FeCl3 C.Fe2(SO4)3 D.FeO
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com