
1.与函数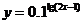 的图象相同的函数解析式是 ( C )
的图象相同的函数解析式是 ( C )
A.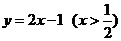 B.
B.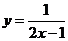
C.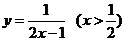 D.
D.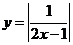
11. (15分)分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、
(15分)分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、
 化妆品等行业有广泛用途。
化妆品等行业有广泛用途。

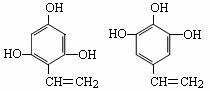
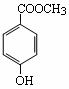 (1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。
 ① 下列对尼泊金酯的判断不正确的是______。
① 下列对尼泊金酯的判断不正确的是______。
 a.能发生水解反应
a.能发生水解反应
 b.能与FeCl3溶液发生显色反应
b.能与FeCl3溶液发生显色反应
 c.分子中所有原子都在同一平面上
c.分子中所有原子都在同一平面上
 d.与浓溴水反应时,1 mol尼泊金酯消耗1
mol Br2
d.与浓溴水反应时,1 mol尼泊金酯消耗1
mol Br2
 ② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 ,
② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 ,
 其中包含的反应类型有 、 。
其中包含的反应类型有 、 。
 (2)C8H8O3的另一种同分异构体甲满足以下条件:
(2)C8H8O3的另一种同分异构体甲满足以下条件:
 ① 与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH
① 与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH
 ② 遇FeCl3溶液显色
② 遇FeCl3溶液显色
 ③ 苯环上的一氯取代物只有一种
③ 苯环上的一氯取代物只有一种

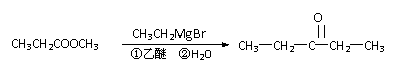 甲可能的结构简式是_______、_______。
甲可能的结构简式是_______、_______。

 (3)已知:
(3)已知:



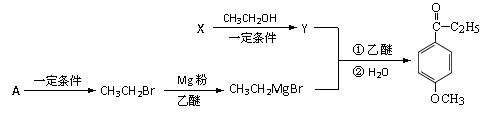 X也是C8H8O3的同分异构体。A在常温下呈气态,其产量是衡量一个国家石油化工水平的标志。
X也是C8H8O3的同分异构体。A在常温下呈气态,其产量是衡量一个国家石油化工水平的标志。




 ① 由A制CH3CH2Br的反应类型是_________。
① 由A制CH3CH2Br的反应类型是_________。
 ② X→Y反应的化学方程式是________。
② X→Y反应的化学方程式是________。


|
(1) ① cd
②
|
水解反应(取代反应)、中和反应(复分解反应)
 (2)
(2)
|
|||
|
|||
(3) ① 加成反应
 ②
②

10.(共14分,计算结果每空3分,其余每空2分)
①酸式,否,紫红色KMnO4溶液被H2C2O4还原为Mn2+时溶液褪色、当最后一滴KMnO4滴入时,溶液中紫红色不再褪去即为滴定终定。
②偏低;
③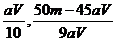
10. (14分)
(14分)
通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
(1)称取mg草酸晶体,配制成100.0mL溶液。
(2)取25.0mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为amol·L-1 KMnO4溶液进行滴定。
 其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
①实验(2)中,KMnO4应装在 滴定管中(填“酸式”、“碱式”),滴定前是否需要在锥形瓶内加入指示剂 (填“是”、“否”),原因是
;
②若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,则根据实验求出的x值 (填“偏高”、“偏低”、“无影响”);
③若滴定终点时,共用去KMnO4溶液VmL,则草酸溶液浓度为 mol·L-1,
x = (用含有m、V的代数式表示)
8.(14分)
(1)四 VIII (2分)
(2)二氧化氮(2分) Fe(OH)3(2分)
|
(3)FeS2(s)+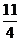 O2(g)
O2(g) 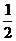 Fe2O3(s)+2SO2(g);△H=-853kJ/mol(2分)
Fe2O3(s)+2SO2(g);△H=-853kJ/mol(2分)
 (4)Fe3++3NH3·H2O
(4)Fe3++3NH3·H2O Fe(OH)3↓+3NH4+(2分)
3Fe+8H++2NO3- 3Fe2++2NO↑+4H2O(2分)
(5)168(2分)

 9.(15分)中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O。请按要求填空:
9.(15分)中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是 ,鉴别这两种气体不能选用的试剂是 。
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是 ,此时溶液中的离子按照浓度由大到小排列的顺序是 。
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成红棕色。若被还原的B的物质的量为2mol时,产生C气体的体积是 L(标况)。将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因 。
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一。C发生水解反应的离子方程式是 。
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阴离子的方法是 (简述操作过程及结论。)
|
(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (2分)
a (1分)
5NaOH+4CO2=Na2CO3+3NaHCO3+H2O (2分)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) (2分)
(2)44.8 (1分)
 2NO2 N2O;△H<0
2NO2 N2O;△H<0
降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅 (3分)
 (3)ClO-+H2O HclO+OH- (2分)
(3)ClO-+H2O HclO+OH- (2分)
(4)取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色沉淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-。 (2分)
8.(14分)下图是多种无机物在一定条件下的转化关系(部分产物及反应条件未列出。)K是形成光化学烟雾及形成酸雨的一种主要气体,N为第三周期元素组成的单质熔点最高的金属,X是一种矿石的主要成份,常用来生产一种常见的化工产品。

回答:
(1)在周期表,组成单质L的元素位于第 周期第 族。
(2)K的名称为 ,G的化学式 ;
(3)已知X的燃烧热为853KJ/mol,写出反应①的热化学方程式:
(4)写出反应⑤的离子方程式:
写出⑩的离子方程式:
(5)反应⑦中,若转移9 mol电子,生成的L g。
7. 下述实验中,不能达到预期目的的是D
下述实验中,不能达到预期目的的是D
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具还原性 |
|
B |
将H2S通入CuSO4溶液中生成黑色沉淀 |
比较H2S与H2SO4的酸性强弱 |
|
C |
一定温度下,压缩一端封闭收集有NO2气体的注射器,使其体积减小 |
研究压强对气体反应化学平衡状态的影响 |
|
D |
分别向2支试管中加入等体积等浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对相同条件的H2O2分解速率的影响 |
6. 假设与猜想是科学探究的先导,在下列假设(或猜想)引导下的探究活动肯定没有实际意义的是 C
假设与猜想是科学探究的先导,在下列假设(或猜想)引导下的探究活动肯定没有实际意义的是 C
 A.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
A.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS

 B.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究SO2和Na2O2反应可能有Na2SO4生成
 C.探究Na与水的反应可能有O2生成
C.探究Na与水的反应可能有O2生成

 D.向滴有酚酞的NaOH溶液中通入 Cl2,探究红色褪去的原因是溶液的酸碱性变化还是HClO的漂白性所致
D.向滴有酚酞的NaOH溶液中通入 Cl2,探究红色褪去的原因是溶液的酸碱性变化还是HClO的漂白性所致
0. 2mol·L-1CH3COOH溶液,溶液pH的变化
2mol·L-1CH3COOH溶液,溶液pH的变化
 曲线如下图所示。下列分析中正确的是( C )
曲线如下图所示。下列分析中正确的是( C )
 A.原溶液中:c(NaOH)=0.2mol·L-1
A.原溶液中:c(NaOH)=0.2mol·L-1
 B.曲线上A到B间任意一点,溶液中都有:
B.曲线上A到B间任意一点,溶液中都有:
 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
 C.在B点处一定有c(CH3COO-)=c(Na+)
C.在B点处一定有c(CH3COO-)=c(Na+)
 D.a =
12.5
D.a =
12.5
4. 若NA表示阿佛加德罗常数,下列说法正确的是 ( A )
若NA表示阿佛加德罗常数,下列说法正确的是 ( A )
A.4.6gNO2和N2O4的混合物,所含氧原子数一定为0.2NA
B.25℃,0.2NA氦气体积不可能为4.48L
C.0.5mol NH+4所含的质子数为5NA
|
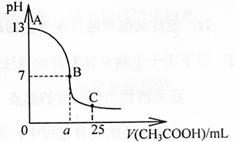 5.25℃时,在25mLNaOH溶液中,逐滴加入
5.25℃时,在25mLNaOH溶液中,逐滴加入
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com