
6.检验Fe+.是向未知溶液滴入少量KSCN溶液呈无色,继续滴入少量氯水呈血红色。
|

[例1](2010全国卷1)能正确表示下列反应的离子方程式是
A.将铜屑加入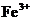 溶液中:
溶液中: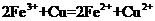
B.将磁性氧化铁溶于盐酸:
C.将氯化亚铁溶液和稀硝酸混合: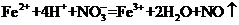
D.将铁粉加入稀硫酸中: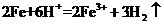
[解析]A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
[答案]A
[命题意图]考查离子方程式的正误判断方法!
[点评]离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D这是个重现率很高的的经典错误,考生绝对做过原题!B项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考题中再次出现,这道题就没什么意思了!A直接取材于课本第二册,C选项,考生也绝对做过,都是太常见不过了!
[例2](2010上海卷)由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A.4:3 B.3:2 C.3:1 D.2:l
答案:BC
解析:此题考查了化学计算知识。分析题给混合物和高温下发生的反应,可知当Fe2O3+Fe=3FeO时,反应后混合物中含有6molFeO、4molFe2O3,则FeO与Fe2O3的物质的量之比为:3:2;当发生反应:Fe2O3+Fe+FeO=Fe3O4时,反应后混合物中含有2molFeO、4molFe2O3,则FeO与Fe2O3的物质的量之比为:1:2;当两反应均存在时,FeO与Fe2O3的物质的量之比处于两着之间,故BC可能。
知识归纳:极端假设法是指根据已知的条件,把复杂问题假设为处于理想的极端状态,站在极端的角度去分析、考虑问题,使其因果关系显得十分明显、简单,从而迅速地作出正确判断的方法。比如此题中我们就假设了两个极端,首先确定两个极端,然后确定范围,最后选择。
[例3](2010福建卷)工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除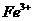 外还可能含有
外还可能含有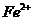 。若要确认其中的
。若要确认其中的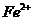 ,应先用
选填序号)。
,应先用
选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水
d.酸性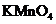 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
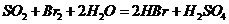
然后加入足量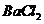 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中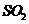 的体积分数为
。
的体积分数为
。
[探究二]
分析上述实验中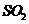 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有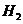 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
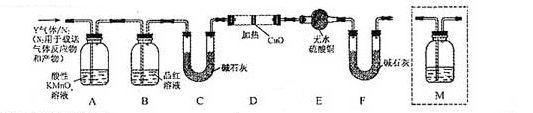
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有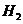 ,预计实验现象应是
。
,预计实验现象应是
。
(7)若要测定限定体积气体Y中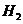 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml 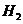 ),除可用测量
),除可用测量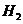 体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
解析: (1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行
(2)+2价亚铁离子能使算话的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰,选c会造成两种沉淀,受氢氧化铁颜色的影响无法辨别
(3)A除去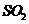 ,B可以检验A中是否完全除去
,B可以检验A中是否完全除去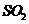
(4)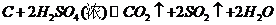
(5)Q为 ,他与二氧化硫一样都能使澄清石灰水便浑浊,选择a或b受二氧化硫的影响无法判断Q的存在;选择d,Q被碱石灰吸收
,他与二氧化硫一样都能使澄清石灰水便浑浊,选择a或b受二氧化硫的影响无法判断Q的存在;选择d,Q被碱石灰吸收
(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝
(7)中学阶段的质量称量选择托盘天平,分度值0.1g,无法精确称量出差量。
5.检验Fe3+.常用方法有:
(1)向未知溶液滴入少量KSCN溶液呈血红色。
(2)向未知溶液滴入少量苯酚溶液呈紫色。
(3)向未知溶液中滴入少量NaOH溶液呈红褐色。
4.铁三角:
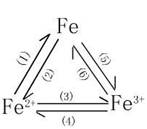 注:(1)一般是指Zn
.Al .CO. H2. 等还原剂。
注:(1)一般是指Zn
.Al .CO. H2. 等还原剂。
(2)是指H+. S. I2. Cu2+. Fe3+.等氧化剂.
(3)(5)是指Cl2. Br2. O2. HNO3. KMnO4等氧化剂.
(4)一般是指Fe. Cu. HI. H2S.等还原剂.
(6)是指Zn. Al. CO. H2. 等还原剂。
根据铁三角有关(1)---(6)的化学方程式如下。
|
|
|
|
(2)Fe+2H+=Fe2++H2↑ Fe+S===FeS Fe+I2===FeI2
Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+
(3)2Fe2++Cl2=2Fe3++2Cl- 2Fe2++Br2=2Fe3++2Br- 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
(4) 2Fe3++Cu=Cu2++2Fe2+ Fe3++Fe=3Fe2+
|
|
|
|
|
3.Fe(OH)2与Fe(OH)3的比较
|
|
Fe(OH)2 |
Fe(OH)3 |
|
颜色状态 |
白色固体 |
红褐色固体 |
|
水溶性 |
不溶 |
不溶 |
|
稳定性 |
易氧化为Fe(OH)3,空气中加热得不到FeO |
较稳定: ∆ Fe(OH)3== Fe2O3+3H2O |
|
与酸的反应 |
Fe(OH)2+2H+=== Fe2+ +3H2O |
Fe(OH)3+3H+=== Fe3+ +3H2O |
|
制法 |
在隔绝O2的条件下Fe2+与碱反应 |
Fe3+与碱反应 |
2.Fe2+ 和Fe3+ 的比较
|
|
Fe2+ |
Fe3+ |
|
水合离子颜色 |
浅绿色 |
棕黄色 |
|
氧化还原性 |
既有氧化性,又有还原性 |
只有氧化性 |
|
水解性 |
Fe2+ +2H2O←→Fe(OH)2+2H+ |
Fe3+ +3H2O←→Fe(OH)3+3H+ |
|
与碱的反应 |
Fe2+ +2OH-=== Fe(OH)2 ↓ |
Fe3+ +3OH-=== Fe(OH)3 ↓ |
1.铁的氧化物的比较
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
俗称 |
- |
铁红 |
磁性氧化铁 |
|
色态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
|
价态 |
+2 |
+3 |
1/3正2价,2/3正3价 |
|
水溶性 |
不溶 |
不溶 |
不溶 |
|
与酸的反应 |
FeO+2H+===Fe2++H2O 遇氧化性酸生成Fe3+ 盐 |
Fe2O3+6H+===2Fe3++3H2O |
Fe3O4+8H+===Fe2++2Fe3++4H2O |
|
与CO的反应 |
高温 FexOy+yCO===xFe+yCO2 |
4.能掌握氢氧化铁胶体制备,能列举合金材料的应用。
|


(1)NO3-与Fe2+在酸性条件下,不能共存。
(2)过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
(3)注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
(4)注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
(5)注意铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
|

第1课时 铁和“铁三角”
3.能用氧化还原反应的规律探究铁的化合物之间的相互转化。
2.通过合金材料了解铜及化合物的性质。
1.了解铁单质及化合物的颜色.状态及性质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com