
9.(泰兴市第一高级中学2009届高三年级第五次周考)(10分)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
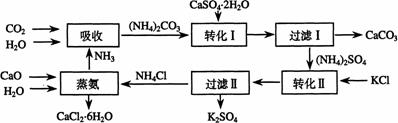
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要________________等原料。
(2)石膏悬浊液中加入碳酸铵溶液后反应的离子方程式为______________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:________
______________________________________________________________________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是因为__________(选填序号)
a. 熔点较低(29℃熔化) b. 能导电 c. 能制冷 d. 无毒
答案)
(1) CaCO3 NH3 H2O(2分)
(2) CaSO4+CO32-→CaCO3↓+SO42-(2分)
(3) CaSO4(2分)
(4) 滤液中滴加盐酸产生气泡(2分)
(5) a d(2分)
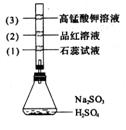
8.(江苏省盐城市重点中学高中2009届第一协作片联考)如图所示,锥形瓶中加入亚硫酸钠固体和1︰l的硫酸,玻璃管内装入分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是[C ]
|
|
(1) |
(2) |
(3) |
|
A |
褪色 |
褪色 |
变红 |
|
B |
变红 |
变红 |
褪色 |
|
C |
变红 |
褪色 |
褪色 |
|
D |
褪色 |
变红 |
褪色 |
6.(江苏省口岸中学09届秋学期高三年级第二次月考)(10分)空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
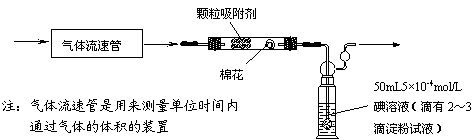
应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
 ⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确 移取50mL5×10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确 移取50mL5×10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:_____________________________________________________ __________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
答案)⑴溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④
7(09江苏赣榆海头中学高三化学第二次月考)研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2 SO3+NO ②SO3+H2O
SO3+NO ②SO3+H2O H2SO4 ③2NO+O2
H2SO4 ③2NO+O2 2NO2
2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( AD )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4
C.浓H2SO4滴入萤石中,加热
D.加入少量的H2SO4使乙酸乙酯水解
5.(江苏省射阳中学2009届高三第二次月考) (12分)最近,我国利用生产磷铵(温度变化其溶解度变化不大)排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下:
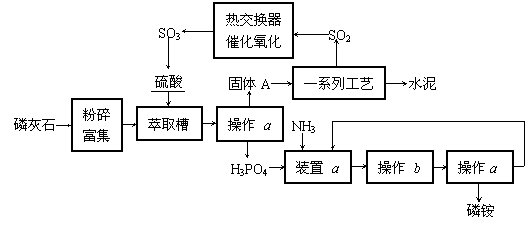
回答下列问题:
⑴若操作a、操作b均在实验室进行,则操作a的名称为 。进行操作b时需注意 。
⑵装置a用于磷酸吸收NH3。若该过程在实验室中进行,请在答题卡的方框内画出装置
a的示意图。
⑶热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目
的,如气、液热交换时通常使用的仪器是 。
⑷固体A为生石膏(CaSO4·2H2O)和不含结晶水且高温时也不分解的杂质。生石膏在
120℃时失水生成熟石膏(2CaSO4·H2O),熟石膏在200℃时失水生成硫酸钙。为测定 固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A 180 g置于坩埚中加 热,加热过程中固体质量随温度变化记录如下图:
 ①将加热到1400℃时生成的气体通入品红
①将加热到1400℃时生成的气体通入品红
溶液中,品红褪色。写出1400℃时的化学
反应方程式 。
②固体A中生石膏的质量分数= 。
答案) ⑴过滤 低温蒸发结晶
⑵(如图或其他能防止氨气倒吸的装置)
⑶ 冷凝管
⑷ ①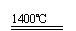 2CaSO4
2CaO+2SO2↑+O2↑
2CaSO4
2CaO+2SO2↑+O2↑
② 95.6%
4.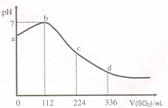 (江苏省射阳中学2009届高三第二次月考)标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是[ AD]
(江苏省射阳中学2009届高三第二次月考)标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中,正确的是[ AD]
A.ab 段反应是:SO2 + 2 H2S=3S↓+2 H2O
B. b 点对应的溶液导电性最强
C.原H2S溶液的物质的量浓度为0.05 mol•L-1
D.相同条件下,酸性强弱:亚硫酸>氢硫酸
3.(淮阳一高09高三一轮复习月考(11月份)水是生命之源,下列有关说法中正确的是 [ D]
A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B.王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt
C.氨水能导电,说明氨气是电解质
D.新制备的氯水中存在三种分子,四种离子
1.(2008-2009学年度江苏省淮阴中学高三第三次调研测试)(16分)某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如下的实验装置。
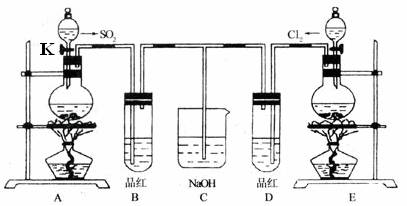
(1)实验室用装置E制备Cl2气体,检查E装置气密性的方法是
(2)实验室用装置A制备SO2气体,写出A中发生反应的化学方程式: 。某同学在实验开始时发现打开A装置中的分液漏斗活塞K后,漏斗中液体并没有流下,你认为可能原因是:
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: :(填写序号)
①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B: ,D: 。
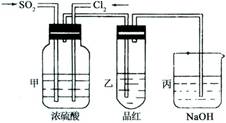 (4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快。为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下实验装置:
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快。为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下实验装置:
①实验开始后,乙装置中出现的现象:
②用离子方程式表示乙中产生该现象的原因:
答案).(1)在D中装水漫过导管一段距离,关闭分液漏斗活塞,用酒精灯加热烧瓶,看到D中有气泡冒出,停止加热有液柱回流,则说明气密性良好。(2分)
(2)H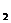 SO
SO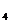 +Na
+Na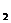 SO
SO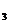 =Na
=Na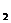 SO
SO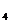 +SO
+SO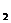 ↑+H
↑+H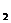 O (2分);
O (2分);
分液漏斗盖子未打开(2分)
(3)①(2分) B:由无色变为红色(2分) D:无明显现象(2分)
(4)①品红未褪色 (2分)
②SO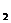 +Cl
+Cl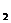 +2H
+2H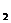 O=4H
O=4H +SO
+SO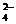 +2Cl
+2Cl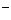 (2分)
(2分)

|
A.5.6 g B.11.2g C.22.4g D.33.6g
(三)卤素单质的化学性质(相似性及递变性)
由于最外层均为 个电子,极易 电子,因此卤素都是 剂,在自然界均只以 态存在.但随着电子层数递增,原子半径渐 ,核对外层电子的引力渐 ,得电子能力渐 ,其氧化性逐渐 ,主要表现:
。
试题枚举
[例1]下列有关氯的叙述中正确的是
A.液氯和氯水是同一物质
B.红磷在氯气中燃烧产生白色烟雾
C.氯气与水的反应中氯是氧化剂,水是还原剂
D.用氯制漂白粉是为了得到易贮存的漂白剂
解析:液氯、氯水都是液体,但前者是纯氯,后者是氯与水的混合物,时间延长氯水中还逐渐生成盐酸和次氯酸,氯分子渐少,氯离子渐多。如果再有光照, 因分解也在渐少,出现氧气和更多盐酸。氯与水的反应是氯分子中氯原子间发生的自身氧化还原,即歧化反应, 水虽然是反应物,却未参加氧化还原。A、C不正确。
烟是分散在气体中的固体小颗粒,雾是分散在气体里的液体小珠滴。磷在氯气里燃烧的产物三氯化磷是无色液体,可发雾;五氯化磷是浅黄色固体,能形成烟。漂白粉和氯都可以作为漂白剂、消毒剂,且氯更有效。但氯气难贮存,又有剧毒,一般医用、家用的漂白剂和消毒剂使氯气是不合宜的,所以制成漂白粉便于贮存和使用。漂白粉保存得当,如密闭,以防止吸水和 而变质,可以存放较长时间。B、D正确。
答案:B、D。
[例2] 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,原因是它们均含有 ( )
A. 氯气 B. 次氯酸 C. 次氯酸根 D. 氯化氢
解析 NaClO及Ca(ClO)2的水溶液中,ClO-水解产生HClO无HCl;有色布条的褪色是因HClO的氧化所致。
答案: B
[变式] 用滴管将新制的氯水慢慢滴入盛酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,发生这一现象的原因可能有两个:
①是由于 (用简要文字说明)
②是由于 (用简要文字说明)
简述用实验方法证明褪色的原因是①还是②
。
[例3]如何鉴别NaCl、NaBr、KI三种白色固体?
解答:
方法一:可用氯水鉴别。
把这三种物质各取少量制成溶液,加入新制的氯水和汽油(或四氯化碳),振荡,分层,使汽油层呈无色的是NaCl;使汽油层呈橙色的是NaBr;呈紫色的是KI。
方法二:可先用焰色反应将KI区分出来。然后再将另外两种物质各取少量制成溶液,加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr。
方法三:直接加入AgNO3溶液。
分别取少量固体制成溶液,分别加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr,有黄色沉淀生成的是KI。
[例4] 多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
|
|
卤素 |
氰 |
硫氰 |
① |
|
“单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
|
酸 |
HX |
HCN |
② |
HOCN |
|
盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、_______、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:______________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
解析:此题主要考查“运用已学知识进行类推思维的能力”。解题时可用熟知的Cl2、HCl、KCl等物质作参照物。由还原性Br-<CN-<SCN-,可推知氧化性Br2>(CN)2>(SCN)2,因而可判断(CN)2只能与KSCN反应,不能与NaBr反应,亦即由物质的氧化性和还原性的强弱,可以判断氧化还原反应能否发生。
答案:(1)氧氰 HSCN KOCN
(2)①(CN)2+2KOH====KCN+KOCN+H2O
②(CN)2+2SCN-====2CN-+(SCN)2
该题为信息给予题,给予的信息是:拟卤素(如(CN)2)的性质与卤素单质相似,由此而可依据卤素单质的性质来进行类比、模拟来解答习题。这是解答信息给予题的一种方法。
[变式] 溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A. IBr是双原子分子
B.在很多反应中IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
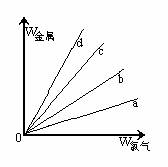 [例5]在右图的四条直线分别表示钠、镁、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ( )
[例5]在右图的四条直线分别表示钠、镁、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ( )
A. a B. b C. c D. d
解析 Cl2与四种金属反应的均为氧化还原反应,在横坐标上取一点作一条垂直于横坐标的直线,分别与a、b、c、d四条直线的交点即为四种金属与等质量Cl2反应时所需的质量。假设这一点的质量为35.5g,此时金属均转移1mol电子,则消耗四种金属的质量分别为:WNa=23g、WMg=12g、WAl=9g、WFe=18.7g,即等质量氯气消耗四种金属的质量是WNa>WFe>WMg>WAl,故a、b、c、d分别代表Al、Mg、Fe、Na与氯气的反应。
答案:C
(二)单质的物理性质
随卤素核电荷数增加,其原子结构的递变而使卤素单质的物理性质呈规律性变化.
归纳:从F2 →I2
1、颜色逐渐 ,状态从 → → ,密度从 → ,熔沸点由 → (原因是 。
2、单质的溶解性--除氟外(与水剧烈反应)在水中溶解度都较 ,且由 → ,都易溶于有机溶剂,下表列出Cl2、Br2、I2在不同溶剂中的颜色.
|
|
水 |
CCl4 |
|
|
Cl2 |
|
|
|
|
Br2 |
|
|
|
|
I2 |
|
|
|
(一)卤素的原子结构
共同点:原子的最外层均为 个电子,都易 1个电子而表现 性;
不同点:核电荷数逐渐 ;电子层数逐渐 ;原子半径依次 ,得电子能力逐渐 ;单质氧化性逐渐 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com