
4.(08山东实验中学一诊)据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 ( )
A.e-2e-=Fe2+
B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑
D.4OH--4e-=2H2O+O2↑
3.(08山东实验中学一诊)在1L K2SO4和CuSO4的混合溶液中c(SO42-) = 2.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(K+)为 ( )
A.2.0 mol•L-1 B.1.5 mol•L-1
C.1.0 mol•L-1 D.0.50 mol•L-1
2.(08枣庄三诊)近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是 ( )
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-→2H2O
1.(08枣庄第一次调研) “暖宝宝”取暖片的材料中含有铁粉、水、活性炭、硅石、食盐等,它们组成一个原电池,
在反应时释放出热量,铁粉在原电池中充当 ( )
A.负极 B.正极 C.阴极 D.阳极
16.(海州高级中学2009届高三化学第三次综合测试)(8分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x =0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数 。
答案).(1)1500+375X (2) 10:33 (3) 52.7%
(1)375x + 1500 (2)10∶3.3
(3)
15.(海州高级中学2009届高三化学第三次综合测试)把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下.)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的是( AD )
A.气体Y是SO2和H2的混合物 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
13、(2008-2009学年度启东市汇龙中学第一次月考)(1) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也
是一种常用的试剂。水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2)随着人类对水的研究的不断深入,水的应用也越来越广泛。研究人员最近发现,
在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称
为“热冰”。“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还可能用来
(填写序号)
A.代替干冰 B.防止冰川熔化 C.在室温下制作冰雕 D.建室温溜冰场
(3)在灾害性事故中,骨折时有发生,通常用石膏来固定骨折部位。石膏可分为熟石
膏(CaSO4·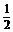 H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是
(填分子式或名称)。石膏定型时发生的化学反应方程式
。
H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是
(填分子式或名称)。石膏定型时发生的化学反应方程式
。
(4)火星探测车在火星大气中检测到了气体A。资料显示,A分子是三原子分子,其
相对分子质量为60,在地球环境下A易分解。粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,,生成物的物质的量之比是1∶1∶1。则气体A的结构式是 。
(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料。它可以用超酸H(CB11H60Cl60)
和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式) 。
答案)、(1)A (2) CD (3) S=C=O(2分)
(4) 熟石灰(1分) 2CaSO4·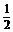 H2O+3H2O===2CaSO4·2H2O(2分)
H2O+3H2O===2CaSO4·2H2O(2分)
(5) NH3+HCl===NH4Cl(2分)
14(江苏省宿迁中学高三实验班化学模拟2)(10分)世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、N、S氧化物的排放有增无减,水资源的紧缺和污染加剧。
(1)大气中氟氯烃的减少带来的积极效应是 。
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质。
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
 NOX +
O2 +
H2O =
HNO3
NOX +
O2 +
H2O =
HNO3
②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为: 。
(3)回收利用SO2既能减少大气污染,又能充分利用资源。已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用。某同学设计测定转化器的脱硫效率方案如下:
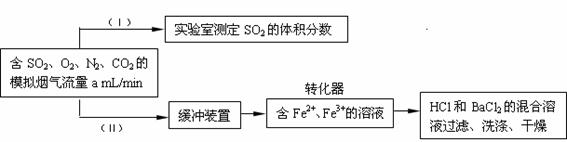 ①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数。
①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数。
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
和 。
答案)

12.(江苏省扬州中学2008-2009学年第一学期第一次月考)把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下.)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的是[ AD ]
A.气体Y是SO2和H2的混合物 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
11.(江苏省扬州中学2008-2009学年第一学期第一次月考)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
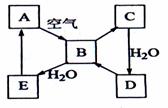
(1)写出A在加热条件下与H2反应的化学方程式
________________________________________________________;
(2)写出E与A的氢化物反应生成A的化学方程式:
__ ;
(3)写出一个由D生成B的化学方程式:
__ ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是:
________ ;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是:
_ 。
答案)(1)H2+S H2S(写成可逆反应也正确)
(每空1分)
H2S(写成可逆反应也正确)
(每空1分)
(2)H2SO3 + 2H2S=3S + 3H2O
(3)C+2H2SO4(浓) CO2 ↑+2SO2 ↑+2H2O
CO2 ↑+2SO2 ↑+2H2O
(或Cu+ 2H2SO4(浓) CuSO4 +SO2 ↑+ 2H2O等)
CuSO4 +SO2 ↑+ 2H2O等)
(4)①H2SO3 +2OH- = SO32- + 2H2O
②大于;Na2SO3溶液中SO32-发生水解使溶液显碱性。
③增大;升高温度促进Na2SO3溶液的水解。
10.(江苏省姜堰市2008-2009学年度第一学期期中考试)(12分)某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数
[方法一]加热转化法
称取a克样品,置于硬质玻璃管中通入氧气加热一段时间,Na2SO3被氧化为Na2SO4 ,则可能发生的化学反应方程式为
;若冷却后称得固体质量为b克,则样品中Na2SO4质量分数为
,该方法的缺点是
。(只要答一点)
[方法二]测 SO2质量法
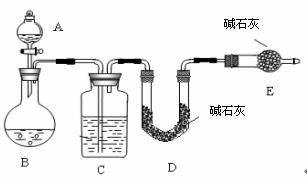
采用如图所示装置,通过实验测定生成SO 2的质量。
(1)A装置的名称 ,A中盛放的试剂是 ,C中盛放的试剂是 。E装置的作用是 。
(2)若实验前称取c克样品,测得SO2的质量为d克,则样品中Na2SO4质量分数为 ,该方法的缺点是 。(只要答一点)
[方法三]测沉淀质量法
第一步:称取e克样品,置于小烧杯中;
第二步:向小烧杯中加入足量稀盐酸,加热;
第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤;
第四步:干燥沉淀,称重为f克。
(1)方案中BaCl2能否改成Ba(NO3)2? (填“能”或“不能”);试简述原因 。
(2)简述洗涤沉淀的方法:
答案)[方法一]2Na2SO3+O2=2Na2SO4 [(142a-126b)/16a]×100%
加热时Na2SO3不一定完全转化
[方法二](1)分液漏斗 稀硫酸 浓硫酸 防止外界水蒸气进入
(2)[1- (126d/64c)]×100% SO2不一定完全被吸收 ,装置中有不少SO2滞留
[方法三]不能,酸性条件下Ba(NO3)2将SO2氧化成BaSO4 向漏斗内加水至刚好浸没沉淀,待水自然流出后再加水洗涤2~3次 ( 每空1分,共12分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com