
11.北京奥运会“水立方”游泳池中的水主要是通过砂滤、臭氧和活性炭来净化的,下列有关说法不正确的是 ( )
A.砂滤是利用过滤原理除去水中较大的固体颗粒
B.臭氧可以消毒杀菌是因为臭氧有强氧化性
C.活性炭可以吸附水中悬浮的杂质
D.游泳池水中的臭氧浓度越大越好
解析:游泳池水中的臭氧浓度不是越大越好.
答案:D
10.(2009·浙江联考)发生严重水体镉污染时,一般采用加入聚合硫酸铁(PFS)[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10,利用PFS在水体中形成絮状物来吸附镉离子.则下列说法中错误的是 ( )
A.核素Cd的中子数为60
B.含镉废电池应进行集中回收处理
C.PFS中铁的化合价为+2价
D.由FeSO4制PFS需经过氧化、水解和聚合过程
解析:设PES中铁的化合价为+x价,根据化合物中各元素的化合价代数和为零可以
列等式:2x=n+2×(3-n/2),所以x=3,即铁的化合价为+3价,C错误.
答案:C
9.如图所示,为防止大气污染、节约燃料、缓解能源危机,燃烧产物如CO2、H2O、N2等可以利用太阳能最终转化为 ( )
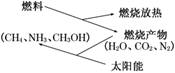
A.生物能 B.化学能
C.热能 D.电能
解析:由转化关系图分析,燃烧产物利用太阳能转化成CH4,NH3,CH3OH以化学能
形式贮存起来.
答案:B
8.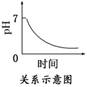 取某地酸雨水样进行分析,发现其pH随时间变化的关系如图所示,
取某地酸雨水样进行分析,发现其pH随时间变化的关系如图所示,
pH变化的主要原因是 ( )
A.亚硫酸的电离程度增大
B.亚硫酸缓慢被氧化
C.酸雨中的水分被蒸发
D.测定的pH有误差
解析:雨水中的H2SO3会逐渐被氧化成酸性更强的H2SO4,故pH会减小.
答案:B
7.在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为目标产物,即原子利用率为100%.在下列反应类型中:
①置换反应 ②化合反应 ③分解反应 ④取代反应
⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应
以上反应类型能体现这一原子最经济原则的是 ( )
A.①②⑤ B.②⑤⑦
C.只有⑦⑧ D.只有⑦
解析:原子利用率100%,即理想地把所有原料转化为目标产物,换句话说,就是不生
成其他的小分子或副产品.满足这一条件的有化合反应、加成反应、加聚反应,这些
反应类型的产物均只有一种.
答案:B
6.化学与科技、社会、生产密切结合,下列有关说法不正确的是 ( )
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.“无磷洗涤剂”的推广使用,能有效减少水体富营养化的发生
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞--臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡
化
解析:海水淡化可以解决淡水供应危机,但向海水中加入明矾不能使海水淡化.
答案:D
5.下列叙述错误的是 ( )
A.炼铁时,还原剂CO将铁从铁矿石中还原出来
B.活泼金属Na用电解法冶炼
C.汞的冶炼可用热分解法
D.铝的冶炼一般用还原剂法
解析:活泼金属K、Na、Ca、Al用电解法冶炼,D错误;多数金属的冶炼用热还原法
如Fe、W、Cr等;有些不活泼金属用热分解法就可制得如Hg、Ag等.
答案:D
4.“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用.下列化学反应不符合绿色化学概念的是 ( )
A.消除硫酸厂尾气中的SO2:
SO2+2NH3+H2O===(NH4)2SO3
B.消除硝酸工业尾气的氮氧化物的污染:
NO+NO2+2NaOH===2NaNO2+H2O
C.制CuSO4:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
D.制 CuSO4:2Cu+O22CuO;
CuO+H2SO4===CuSO4+H2O
解析:A、B两项中在消除硫酸厂的尾气SO2、硝酸厂尾气氮氧化物均符合“绿色化学”的含义,D项制取CuSO4时不产生大气污染物且节约原料也符合要求,只有C项中会产生大气污染物SO2,故选C.
答案:C
3.下列有关环境问题的说法正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6-7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
解析:燃煤中的硫元素经燃烧后产生SO2,可以和石灰石分解生成的CaO反应,生成CaSO3,SO2被吸收,A正确;臭氧在空气中超过10-4%时对人体健康有害,B错误;pH<5.6的雨水称为酸雨,C错误;含磷洗涤剂容易引起水体富营养化而污染环境.
答案:A
2.(2010·南京模拟)天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO、Br-、CO、HCO等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
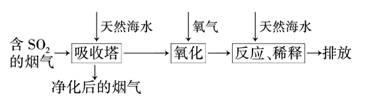
下列说法错误的是 ( )
A.天然海水pH≈8的原因是海水中的CO、HCO水解
B.“氧化”是利用氧气将H2SO3、HSO、SO等氧化生成SO
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D.“排放”出来的海水中SO的物质的量浓度与进入吸收塔的天然海水相同
解析:D项,排放出的海水中吸收了SO2气体,并通过氧化生成了SO,故SO的
物质的量浓度大于进入吸收塔的天然海水,故不正确.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com