
0.067 g/L.
答案:(2)Cl2+2Br-===Br2+2Cl- 将Br2吹出
(3)3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑
(4)5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O 1.6 g
(5)0.067
20.(9分)某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水除去悬浮杂质氧化剂氧化Br2(g)
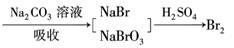
(1)取24 L除去悬浮杂质后的海水,浓缩至2 L;
(2)向其中通入足量Cl2,反应的离子方程式:________________________________,通
入热空气的目的:______________________________;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程
式:__________________________,产生的CO2通入足量澄清石灰水中,得到1 g白
色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:
____________________________,理论上可以得到Br2的质量为________;
(5)请计算海水中溴的浓度为________g/L.
解析:通过反应Cl2+2Br-===Br2+2Cl-置换出溴单质后,一般用热空气或水蒸气将
Br2吹出;根据各步反应,可确定如下关系:Br2-CO2-CaCO3,根据CaCO3的质量
可求出原24 L海水中Br2的质量为=1.6 g,则海水中溴的浓度为=
19.(8分)从煤中可以得到苯及苯的同系物,苯及苯的同系物是重要的有机化工原料.
(1)从煤中得到煤焦油的方法为________;
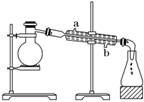
(2)用下面装置从煤焦油中分离出苯及苯的同系物,还需要的仪器为________,冷疑管
进水口为________(填“a”和“b”);
(3)用甲苯可以制造一种烈性炸药TNT,反应如下:
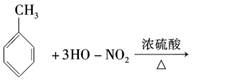
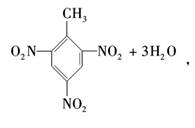
其反应类型为________;
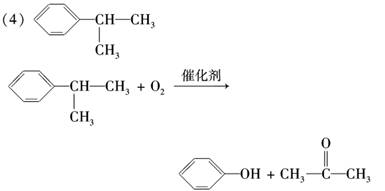
(4)用苯和丙烯可以生产两种重要的有机化工原料:苯酚和丙酮.生产流程如下:
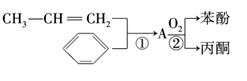
已知反应①是加成反应,A的一氯代物有5种,则A结构简式为__________________;
反应②的化学方程式为_________________________________________________.
解析:CH3-CH===CH2和 加成可以得到
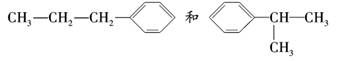
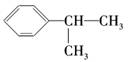
两种加成产物,但前一种一氯代物有6种,后一种一氯代物有5种,故A为
,然后写出符合要求的化学方程式即可.
答案:(1)干馏 (2)酒精灯、温度计 b (3)取代反应
18.(8分)19世纪末,中国开始兴办近代钢铁工业.经过百余年艰苦曲折的发展历程,中
国钢产量在20世纪末突破一亿吨,居世界第一位.完成下列问题:
(1)生铁是通过高炉冶炼而得,冶炼过程中一氧化碳还原赤铁矿的化学方程式为________________________________________________________________________.
(2)铁在一定条件下可与多种非金属单质反应,铁与氯气反应的化学方程式为
________________________________________________________________________,
铁与硫反应的化学方程式为____________________________________________.
(3)今有一铁屑和铝屑的混合物110 g,其中铝屑的质量分数为49%,试计算该混合物与
适量稀硫酸反应能释放出氢气的体积为________(标准状况).
解析:(1)赤铁矿的主要成分是Fe2O3,因其为赤红色而得名.
(2)Cl2的氧化性比S强,能将Fe氧化成+3价,而S只能将Fe氧化成+2价.
(3)混合物中含铝110 g×49%=54 g
含铁110 g-54 g=56 g
n(Fe)==1.0 mol
n(Al)==2.0 mol
依据反应式Fe+H2SO4===FeSO4+H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
则2.0 mol铝与酸反应释放出3.0 mol氢气,1.0 mol铁与酸反应释放出1.0 mol氢气,
共释放出氢气22.4 L/mol×4.0 mol=89.6 L.
答案:(1)Fe2O3+3CO2Fe+3CO2
(2)2Fe+3Cl22FeCl3 Fe+SFeS
(3)89.6 L
17.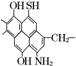 (8分)已知煤的结构模型如下图所示:
(8分)已知煤的结构模型如下图所示:
(1)从煤的结构模型来看,煤是工业上获得________烃的重要来源.
(2)我国大约70%的煤是直接用于燃烧的.从煤的结构模型来看,煤在提
供热量的同时产生大量的________等气体物质,造成严重的大气污染.
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物
苯并芘的排放量也减少,同时节煤20%-30%.“型煤”技术的原理是利用固硫剂在燃
烧过程中生成稳定的硫酸盐.下列物质中适宜于作固硫剂的是________.(填字母)
A.氯化钙 B.氧化钙
C.硫酸钙 D.氢氧化钙
(4)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程
________________________________________________________________________
________________________________________________________________________.
(5)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,
煤资源的综合利用方法还有__________、__________、____________等.
解析:(1)煤结构中含有较多的苯环,隔绝空气给煤加强热可以使它分解,从而获得芳
香烃.
(2)煤结构中含有S和N,所以直接燃烧煤能产生SO2和氮氧化物,污染环境.
(3)煤燃烧产生SO2,固硫过程是使其生成稳定的硫酸盐,所以固硫剂可选用氧化钙或
氢氧化钙.固硫反应为:
SO2+CaOCaSO3,2CaSO3+O2△2CaSO4或2CaO+2SO2+O2高温2CaSO4,
Ca(OH)2+SO2===CaSO3+H2O,2CaSO3+O2△2CaSO4.
(4)若利用石灰石作固硫剂,则发生的反应可表示为:
CaCO3高温CaO+CO2↑;2CaO+2SO2+O2高温2CaSO4.
(5)煤的干馏、气化和液化是提高煤的利用价值的常用方法.
答案:(1)芳香
(2)二氧化硫、氮氧化物
(3)BD
(4)CaCO3高温CaO+CO2↑、2CaO+2SO2+O22CaSO4
(5)煤的干馏 气化 液化
16.(2009·广东高考)广东正在建设海洋强省.下列说法不正确的是 ( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获是Fe、Co、K、Au、Mg、B等金属
解析:D选项中,B不是金属.
答案:D
15.(2010·茂名测试)世界上60%的镁是从海水中提取的,其主要步骤如下:①把贝壳制成石灰乳 ②在海水中加入石灰乳,过滤,洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤 ④在氯化氢热气流中干燥晶体 ⑤电解上述晶体的熔融物.下列说法正确的是 ( )
A.镁元素在元素周期表中位于第四周期、ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是加快干燥速度
D.步骤⑤也可以采用电解该晶体水溶液的方法
解析:制备原理是①CaCO3―→CaO―→Ca(OH)2,②Mg2++2OH-===Mg(OH)2,
③Mg(OH)2+2H+===Mg2++2H2O,④获得MgCl2晶体,⑤MgCl2(熔融)Mg+
Cl2↑.
A项错,Mg在第三周期;B项正确,洗涤Mg(OH)2沉淀时,只要检验不到Ca2+,沉
淀即被洗净;C项错,在HCl气流中加热晶体,主要是防止MgCl2水解生成碱式氯化
镁[Mg(OH)Cl];D项错,若电解MgCl2水溶液则不能生成Mg,而是生成Mg(OH)2.
答案:B
14.下图是某燃煤发电厂处理废气的装置示意图.装置内发生的主要反应中不含( )
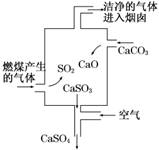
A.化合反应 B.分解反应
C.置换反应 D.氧化还原反应
解析:处理废气的反应原理有:CaCO3CaO+CO2↑,SO2+
CaO===CaSO3,2CaSO3+O2===2CaSO4,未涉及置换反应.
答案:C
13.工业上冶炼金属,常用的方法有四种:Ⅰ.热分解法,Ⅱ.热还原法,Ⅲ.电解法,Ⅳ.湿法冶金.下表中金属与常用冶炼方法相符的是 ( )
|
|
金属 |
冶炼方法 |
|
A |
钾、钙 |
Ⅳ |
|
B |
钠、铝 |
Ⅲ |
|
C |
铜、铁 |
Ⅰ |
|
D |
银、汞 |
Ⅱ |
解析:K、Ca、Na、Al等活泼金属使用电解法冶炼,Cu、Fe等金属使用热还原法冶
炼,Ag、Hg等不活泼金属使用热分解法冶炼.
答案:B
12.下列叙述正确的是 ( )
①生活中用电解饱和食盐水的方法制取消毒液是利用了盐的水解的原理 ②乙醇和汽油都是可再生资源,所以应大力全面推广使用乙醇汽油 ③SO2、NO2和CO2都会导致酸雨的形成 ④CO2的大量排放会造成温室效应的加剧 ⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能 ⑥自然界中“滴水穿石”的化学现象涉及的反应中无氧化还原过程
A.①②③ B.①②⑤
C.③④⑥ D.④⑤⑥
解析:电解饱和食盐水制取消毒液的思路是:电解NaCl溶液,产生Cl2和NaOH,二
者反应生成NaClO,与盐的水解无关;汽油不是可再生资源;能够引起酸雨的主要物
质为SO2、NO2.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com