
8.下列各组离子在溶液中能大量共存的是
A.Na+ Al3+ Cl- SO42- B.Cu2+ Cl- NO3- OH-
C.H+ Na+ CO32- NO3- D.H+ SO42- NO3- OH-
7.下列反应的离子方程式不正确的是
A.水晶与氢氧化钾溶液共热:SiO2+2OH-═SiO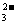 +H20
+H20
B.在小苏打溶液里加入足量的石灰水:Ca2++HCO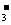 +OH-═CaCO3↓+H2O
+OH-═CaCO3↓+H2O
C.在水玻璃中通入二氧化碳气体;SiO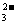 +CO2+H2O═H2SiO3↓+CO
+CO2+H2O═H2SiO3↓+CO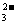
D.在烧碱溶液中通入过量二氧化碳气体:2OH-+CO2═CO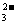 +H2O
+H2O
6.NA代表阿伏加德罗常数。下列有关NA的叙述中,正确的是
A.1 mol 任何物质所含的微粒数均为NA
B.14 g氮气所含的N原子数为NA
C.标准状况下,22.4 L水所含的H2O分子数为NA
D.在钠与氧气的反应中,1 mol钠失去电子的数目为2 NA
5.科学家发现一种化学式为H3 的氢分子。 1 mol H3和1 mol H2 具有相同的
A.分子数 B.原子数 C.质子数 D.电子数
4.下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是
A.氢氟酸 B.硫酸 C.碳酸钠溶液 D.氢氧化钠溶液
3、许多国家十分重视海水资源的综合利用下列不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
2.下列四种化学操作名称从左到右分别是
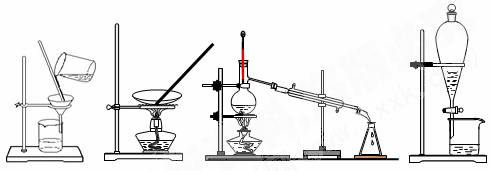
A.过滤、蒸发、蒸馏、萃取 B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取 D.萃取、蒸馏、蒸发、过滤
文理全做
1、目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
22.(11分)氮的氧化物(用NOx表示)是大气污染物,必须加以处理.
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环
的无毒气体.反应的化学方程式可表示为: ___________________________________.
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物
质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.提供的装置如下:
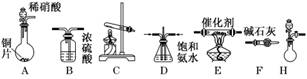
步骤一:NH3的制取
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号).
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
|
试剂组 |
|
|
|
|
合序号 |
固体试剂 |
|
NH3体积 |
|
a |
12.0
g Ca(OH)2(过量) |
10.8
g NH4Cl |
2 688 mL |
|
b |
10.8
g (NH4)2SO4 |
2 728 mL |
|
|
c |
12.0
g NaOH(过量) |
10.8
g NH4Cl |
3 136 mL |
|
d |
10.8
g (NH4)2SO4 |
3 118 mL |
|
|
e |
12.0
g CaO(过量) |
10.8
g NH4Cl |
3 506 mL |
|
f |
10.8
g (NH4)2SO4 |
3 584 mL |
分析表中数据,实验室制NH3产率最高的是:________(填序号),其他组合NH3产率
不高的原因是: _______________________________________________________
 ________________________________________________________________________.
________________________________________________________________________.
步骤二:模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式: _____________________________________________.
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是:
________________________________________________________________________.
③D装置中的液体可换成________(填序号).
a.CuSO4溶液 b.H2O
c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是:_
_______________________________________________________________________.
解析:(1)由CO、NOx在催化剂作用下转变为参与大气循环的无毒气体,根据元素守恒,可知生成物为CO2和N2.(2)步骤一:①快速、简便的制氨装置是H,在分液漏斗中放入浓氨水,在圆底烧瓶中放入碱石灰或氢氧化钠固体将浓氨水加入固体反应物上即可以制取氨气.②C装置采用的是加热固体制取氨气的方法,由于所给碱均过量,产率高低就是看铵盐的量与所得氨气量之间的关系,(NH4)2SO4-2NH3,NH4Cl-NH3,用实际产生氨气的量除以理论产生氨气的量即为产率,计算可得产率最高的是f,其他组合产率不高的原因可能有两个,一是氢氧化钠、氢氧化钙作反应物产生的水较多,吸收的NH3较多;二是氯化铵加热后,有一部分分解后在试管口附近重新结合成氯化铵而影响了产率.步骤二:①A中反应的离子方程式为:3Cu+8H++2NO===3Cu2++2NO↑+4H2O.②D装置的另一个作用是防止NH3溶解而引起倒吸.③D中的液体可换成不与氨气和NO反应的液体,硫酸铜会与氨气反应,不可用,水会吸收较多的氨气也不可用,浓硫酸会吸收氨气,不可用,故只能用四氯化碳.④实验中的明显缺陷是未反应的NO无吸收处理装置,会造成环境污染.
答案:(1)2xCO+2NOx催化剂△2xCO2+N2
(2)步骤一:NH3的制取
①H ②f 因为NH4Cl受热分解生成的部分NH3和HCl又重新结合成NH4Cl;用
NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多
步骤二:模拟尾气的处理
①3Cu+8H++2NO===3Cu2++2NO↑+4H2O
②防止氨气溶解(或防止倒吸)
③c
④未反应的NO无法处理,会污染环境
21.(8分)(2010·潍坊检测)海水占地球总储水量的97.2%,若把海水淡化和化工生产结合
起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表______族.
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将水变成蒸气,
蒸气经冷却而得高纯度淡水.由此可判断蒸馏法是________(填“物理变化”或“化学
变化”).
(3)工业上利用电解饱和食盐水的方法,可制得重要化工产品.反应式为 食盐+
H2ONaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是______________;
利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t.
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回
收二氧化硫的方法.该方法流程如下:
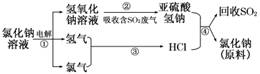
请写出②、④的化学反应方程式________________________________________
________________________________________________________________________.
解析:(1)氯化钠中的金属元素为钠,它应位于元素周期表的ⅠA族.
(2)将海水蒸馏变成水蒸气属于物理变化.
(3)食盐的化学式即NaCl,要制36.5%的浓盐酸1000 t所消耗的食盐应为
×58.5 g/mol=585 t.
(4)由图示给出的反应物和生成物不难写出②的反应方程式为NaOH+
SO2===NaHSO3,④的反应方程式为NaHSO3+HCl===NaCl+H2O+SO2↑.
答案:(1)ⅠA (2)物理变化 (3)NaCl 585
(4)NaOH+SO2===NaHSO3
NaHSO3+HCl===NaCl+H2O+SO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com