
8.(08山东省威海市08质量检测)(8分)I.(1)已知298K时2C(s)+O2(g)=2CO(g) △H1=-221.01kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ·mol-1
则298K时CO(g)在O2(g)燃烧生成CO2(g) 的热化学反应方程式为:
;
(2)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。
该电池工作时的负极反应式为: ;
熔融盐中CO32-的物质的量在工作时 (填“增大”、“减少”、“不变”)。
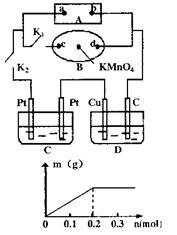 II.如右图所示,A为电源,B为浸透饱和食盐水和酚
II.如右图所示,A为电源,B为浸透饱和食盐水和酚
酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D
为电解槽,其电极材料及电解质溶液见图。
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向
c端移动,则电源a端为 极,通电一段时间后,
观察到滤纸d端出现的现象是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为
7. (08山东省潍坊一中高三4月模拟测试)目前科学家已经开发的便携式固体氧化物燃料电池,它以烷烃气体为燃料,每填充一次燃料,大约可连续几小时甚至几十小时输出50W的电力。这种电池一极通入空气,另一极通入烷烃气体,电解质是固态氧化物,该固体氧化物在熔融状态下能传导O2-,假设该烷烃使用的是甲烷,下列对该燃料电池叙述正确的是: A、在熔融电解质中,O2-由负极移向正极 B、负极的电极反应方程式为:CH4+4O2--8e-=CO2+2H2O C、电路中每流过1mol电子,约有5.6L甲烷被完全氧化 D、通甲烷的电极为电池正极
6. (08山东省潍坊一中高三4月模拟测试)(12分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3,但当铁过量时,产物是 Fe (NO3) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12 中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
(1)提出假设: A 是 FeCl3, B 是 FeCl2。
(2)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
 (3)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:
(3)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
(4)为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是_______________(填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeC13固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加入适量的盐酸调节溶液的 pH = 1 ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)______________________________________________________________。
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
答案.(2)溶液变红色 (1分) FeCl2 (1分)
(3)2Fe十3Cl2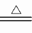 2FeCl3
(l分)
2FeCl3
(l分)
(4)BD (2分)
(5)方案1:Fe3+ >Cu2+ > H + > Fe2+ (l分)
方案2:阴(l分)
Fe 3++ e 一= Fe2+;Cu2+ + 2e 一=Cu ;2 H + + 2e一=H2 ↑;(3分)
污染性气体C12 产生;使用了电解装置,成本较高等。(2分)
5. (08山东临沂质量检测一) (7分)下图表示各物质之间的转化关系。已知:A、D、F、H 均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:
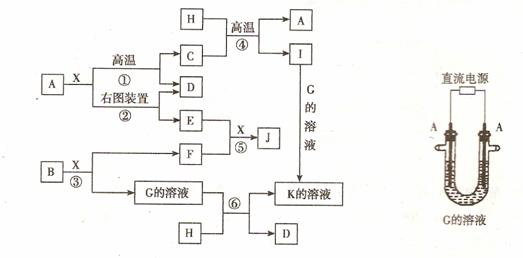
(1)写出生成E的电极反应式: ,反应⑤的现象是 。
(2)反应①的化学方程式是 ,在实验室中引发反应④的操作是 。
(3)反应⑥的离子方程式是 。
答案(1)阴极:2H+ + 2e- = H2↑ 阳极:Fe-2e- = Fe2+ 固体由白色变为灰绿色,最后变为红褐色
(2)3Fe+4H2O(g) 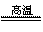 Fe3O4+4H2 将镁条插入混合物中,加入少量氯酸钾,点燃镁条
Fe3O4+4H2 将镁条插入混合物中,加入少量氯酸钾,点燃镁条
(3)2Al+2 OH-+2 H2O = 2AlO-+3H2↑
4. (08山东临沂质量检测一) 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池 总反应式为:
Pb+PbO2+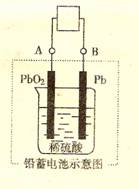 4H++ 2SO4+
4H++ 2SO4+ 2PbSO4
+2H2O
2PbSO4
+2H2O
则下列说法正确的是:
A. 放电时:电流方向由B到A
B. 充电时:阳极反应是PbSO4 - 2 e- + 2H2O = PbO2 + SO42- +4H+
C. 充电时:铅蓄电池的负极应与充电器电源的正极相连
D. 放电时:正极反应是 Pb - 2e- +SO42- = PbSO4
3.(08山东省沂水三中第二次诊断性)(17分)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是
;
。(请写两条)
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学化方程式:H2(g)+1/2O2(g) H2O(l);△H=-285.8kJ/mol
C(g)+O2(g)=CO2(g);△H=-393.5kJ/mol
C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l);△H=890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是 ,通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
(3)已知:H2(g)=H2(l);△H=-0.92kJ/mol O2(g) O2(l);△H=-6.84kJ/mol
H2O(l)=H2O(g);△H=44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式: 。
如果此次嫦娥一号所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量 kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极: ; 正极: ;
总反应式: 。
(5)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L-1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。(写出计算过程)
①若溶液体积仍为100mL,此时溶液的pH为多少?(不考虑硫酸铜水解)
②此时氢氧燃料电池中消耗H2和O2的质量各是多少?(保留2位小数)
答案(1)相同质量时,氢气放出的热量多(1分);产物为水,无污染(1分)
(2)H2(1分),4.4:1(1分)
(3)H2O(l)+1/2O2(l) H2O(g);△H=-237.46kJ/mol(2分) 5.94×108(2分)
(4)负极:2H2+4OH--4e- 4H2O(1分)正极:O2+2H2O+4e- 4OH-(1分)
总反应式:2H2+O2 2H2O(1分)
(5)(①3分;②3分)
①阴极反应为:Cu2++2e-=Cu 2H++2e-=H2↑
当阴极收集到氢气0.112L时,铜已反应完全,共转移电子0.03mol,
此时阳极2Cl--2e-=Cl2↑反应恰好完全。
溶液中剩余的[OH-]=0.1mol/L,溶液PH=13。
②设消耗H2和O2的质量分别为x、y。
2H2 + O2 2H2O ~ 4e-
4g 32g 4mol
x y 0.03mol
解得:x=0.03g y=0.24g
所以,消耗H2 0.03g;消耗O2 0.24g。
2.(08山东省沂水三中第二次诊断性)工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( B )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的阴极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应为Cl2+2e-=2Cl-
4. 与苯的反应:
☆三大强酸的对比
|
|
硝酸 |
硫酸 |
盐酸 |
|
重要物理性质 |
纯净硝酸为无色液体,常见浓硝酸因溶有分解产生的NO2 而呈黄色,易挥发。能以任意比与水混溶 |
无色油状液体,难挥发。能以任意比与水混溶 |
纯净盐酸为无色液体,常见盐酸含有工业杂质(Fe3+)而呈黄色 |
|
重要化学性质 |
强酸性;不稳定性,受热见光易分解;浓稀硝酸均有强氧化性 |
强酸性;稀硫酸只表现酸性,浓硫酸既表现酸性又表现吸水性、脱水性、强氧化性 |
强酸性;还原性(浓度越大还原性越强) |
|
实验室制法 |
硝酸钠与浓硫酸微热 |
|
氯化钠与浓硫酸强热 |
|
工业制法 |
NH3 ~NO~NO2 ~HNO3
注:NO循环氧化吸收 |
FeS2~2SO2 ~2SO3
~2H2SO4 注:SO2 循环氧化吸收 |
H2 在Cl2 中燃烧生成的HCl 用水吸收 |
☆关于浓酸变稀的问题
从上表中可看出三大强酸有一个共同的特点--浓度不同时所表现的性质有所不同,记住此点会给我们解题带来重要突破。记住下列反应:
4HNO3(浓) + Cu = Cu(NO3)2 + 2NO2 ↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
2H2SO4(浓)+ Zn = ZnSO4 + SO2 ↑+2H2O
H2SO4(稀) + Zn = ZnSO4 + H2 ↑
 4HCl (浓 + MnO2
MnCl2 +Cl2
↑+2H2O
4HCl (浓 + MnO2
MnCl2 +Cl2
↑+2H2O
试题枚举
[例1]Murad等三位教授提出NO在人体内有独特的功能,关于NO的叙述正确的是
①NO可以是某些含低价氮物质氧化的产物
②NO不是亚硝酸酐
③NO可以是某些含高价氮物质还原的产物
④NO是无色气体
A.全部 B.①③④
C.②③④ D.①④
解析:NO中氮的化合价处于中间价态,它可以是还原产物,如HNO3→NO,也可以是氧化产物,如NH3→NO;HNO2的酸酐是N2O3;NO是无色气体。所以,所给的几种说法都正确。
答案: A
[例2]“摇摇冰”是一种即用冷的饮料,吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会致冷。该化学物质是
A NaCl B NH4NO3(s) C NaOH(s) D CaO(s)
解析:溶解过程中伴随着能量的变化,固体硝酸铵溶于水吸热,使温度降低,固体氢氧化钠溶于水放热,使溶液温度升高,生石灰与水的反应也放出大量的热,氯化钠溶解过程中能量的变化很小。
答案:B
[例3]同温同压下,在3支相同体积的试管中分别充有等体积的2种气体,它们是(1)NO和NO2(2)NO2和O2(3)NH3和N2。现将3支试管均倒置于水槽中,充分反应后剩余气体的体积分别是V1、V2、V3,则下列关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V3>V1>V2
解析:设每种气体的体积为1体积,则:(1)中剩余1+(1/3)=4/3体积气体;(2)中剩余3/4体积的氧气;(3)中剩余1体积的N2.
答案:B
在进行氮氧化物计算时,要注意有关循环氧化、由多步反应合并所得总反应的应用。记注下列反应:
4NO2 + O2 + 2H2O = 4HNO3 4NO +3O2 + 2H2O = 4HNO3
NO2 + NO + 2NaOH = 2NaNO2 + H2O 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
[变式]在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水中,足够时间后,试管内气体体积缩小为原来体积的3/5,则远混合气体中N2和NO2的体积比
A.2:3 B.3:2 C.3:5 D.5:3
答案:A
3. C与浓硝酸的反应:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com