
3.检验方案的设计和分析
预习导引:
2.焰色反应
1.NH4+ SO42- Cl- 离子的检验
5.红外光谱仪
学习难点:
4.掌握焰色反应
3.学会检验物质的方法、方案设计、实验现象的分析
2.掌握NH4+ SO42- Cl- 离子的检验方法
1.让学生对物质的检验有一个初步的认识、运用
9.(08山东省威海市模拟)(13分)化学能的利用是化学研究
的重要方面,化学能的利用包括化
学能与热能、光能、电能的转化。
(1)化学能与光能的说法不正确的
是 (填编号)。
A.化石能源是远古太阳能转化为化学能而储存下来的
B.光能转化为化学能最重要的是植物的光合作用
C.利用太阳能分解水制取氢气是光能转化为化学能的过程
D.灯泡通电发光就是灯泡把化学能转化为光能的过程
(2)化学能与热能
肼(N2H4)又称联氨,是一种可燃性的液体。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g); △H= +67.7kJ/mol
N2H4(g)+ O2(g)=N2(g)+2H2O(g); △H=-534kJ/mol
则肼和NO2反应的热化学方程式为
(3)化学能与电能
 ①高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳
①高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳
 定的放电电压,高铁电池的总反映为3Zn+2K2FeO4+8H2O 3Zn(OH)2+
定的放电电压,高铁电池的总反映为3Zn+2K2FeO4+8H2O 3Zn(OH)2+
2Fe(OH)3+4KOH
则放电时正极材料是 ,负极电极反应式为 ,
放电时 极附近溶液的碱性增强。
②高铁酸钾(K2FeO4)是一种强氧化剂,工业上可先得高铁酸钠,制备高铁酸钠的两种方法的主要反应原理如下;
湿法制备--2Fe(OH)3+3ClO-+4OH- = 2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
然后在低温下向高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。
由以上信息可知:高铁酸钠溶解度比高铁酸钾 (填“大”或“小”),每生成1molNa2FeO4湿法和干法转移的电子数比为 ,K2FeO4可以和水反映生成铁的氢氧化物和氧气,则该反映的离子方程式为 (不必配平)
答案 (1)D
(2)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ/mol
(3)①K2FeO4(1分);Zn-2e-+2OH-=Zn(OH)2;正(1分)。
②大(1分);3:5;FeO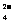 +H2O→Fe(OH)3+O2↑+OH-
+H2O→Fe(OH)3+O2↑+OH-
0.1mol,打开K1,关闭K2,通电一段时间后,阴极析
出固体质量m(g)与通过电子的物质的量n(mol)关系如
图所示。则Cu2+、X3+、H+氧化能力由大到小的顺序是
;D装置Cu极的电极反
应式为 。
答案I.(1)CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
(或2CO(g)+ O2(g)=2CO2(g) △H=-566.0kJ·mol-1)
(2)CO+CO32-=2CO2+2e-;不变
II.(1)+(正极)变红
(2)Cu2+>H+>X3+;Cu→Cu2++2e-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com