

6.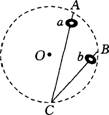 如图所示,AC、BC为位于竖直平面内的两根光滑细杆,A、B、C 三点恰好位于同一圆周上,C为该圆周的最低点,a、b为套在细杆上的两个小环.两小环同时分别从A、B点由静止下滑,则 ( )
如图所示,AC、BC为位于竖直平面内的两根光滑细杆,A、B、C 三点恰好位于同一圆周上,C为该圆周的最低点,a、b为套在细杆上的两个小环.两小环同时分别从A、B点由静止下滑,则 ( )
A.a环先到达C点
B.b环先到达C点
C.a、b环同时到达C点
D.由于两杆的倾角未知,无法判断两环到达C点的先后
5.匀速上升的升降机顶部悬有一轻质弹簧,弹簧下面挂有一个小球.若升降机突然停止,在地面上的观察者紫珠看来,小球在继续上升的过程中 ( )
A速度逐渐减,J
B.速度先增大后减小
C加速度逐渐增大
D.加速度逐渐减小
4.黑柱到“超级市场”参加义务劳动,他将运送货物所用的平板车固定在水平地面上,再用4.0 X 102 N的水平力推动一箱1.0 X 102 kg的货物时,该货物刚好能在平板车上开始滑动;若黑柱推动平板车由静止开始加速前进,要使此箱货物不从车上滑落,则他推车时车的加速度的取值可以为 ( )
A.3.2 m/s2 B.5.5 m/s2
C.6.0 m/s2 D.2.8 m/s2
3.叠放在一起的A、B两物体在白胖的水平拉力F的作用下,沿水平面以某一速度匀速运动,
现白胖突然将作用在B上的力F改为作用在A上,并保持大小和方
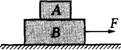 向不变,如图所示,则关于A、B的运动状态可能为 ( )
向不变,如图所示,则关于A、B的运动状态可能为 ( )
A.一起匀速运动 B.一起加速运动
C.A加速,B减速 D.A加速,B匀速
2.雨滴从空中由静止落下,若雨滴下落时空气对其的阻力随雨滴下落速度的增大而增大,
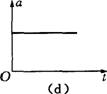
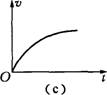 下列图象可能正确反映雨滴下落运动情况的是 ( )
下列图象可能正确反映雨滴下落运动情况的是 ( )
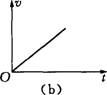
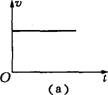
A(a)图 &(b)图 C.(c)图 D.(d)图
1.在交通事故的分析中,刹车线的长度是很重要的依据,刹车线是汽车刹车后,停止转动的轮胎在地面上发生滑动时留下的痕迹.在某次交通事故中,汽车的刹车线长度是14 m,假设汽车轮胎与地面间的动摩擦因数恒为0.7,则汽车刹车前的速度为(g取10 m/s2)( )
A.7m/s B.10m/s C.14m/s D.20m/s
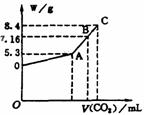 19.(8分)往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量(W)的关系如图所示。试解答下列问题:
19.(8分)往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量(W)的关系如图所示。试解答下列问题:
(1)A点时,白色固体M的化学式为 ,通
入的CO2的体积为 mL(标准状况下,下同。)
(2)C点时,白色固体M的化学式为 ,通入
的CO2的体积为 mL
(3)B点时M的组成成分为 (用学式表
示),通入的CO2的体积为 mL
(4)该NaOH溶液的物质的量浓度为 。
20.(8分)0.15mol某金属单质与足量的稀硫酸充分反应后,在标准状况下生成5.04L H2和25.65g该金属的硫酸盐。若该金属元素原子核内的质子数比中子数少一个,试通过计算确定该金属元素在周期表中的位置。
|
位置如图所示。已知它们的原子序数之和为46,最外层电子
数之和为22。试完成下列问题:
(1)D元素的阴离子的离子结构示意图为
(2)A、C、D的最高价氧化物所对应的水化物 酸性由强到弱的顺序是:
(3)用有关的方程式解释B元素的氢化物的水溶液的酸碱性:
(4)写出A单质与C的最高价氧化物对应水化物反应的化学方程式:
(5)请根据下面所给的5个热化学方程式,计算出反应④的反应热△H4= .
①NH3(g)+HCl(g)=NH4Cl(s);△H1=-176kJ·mol-1
②NH3(g)+H2O(l)=NH3·H2O(aq);△H2=-35.1kJ·mol-1
③HCl(g)+H2O(l)=HCl(aq);△H3=-72.3kJ·mol-1
④NH4Cl(s)+H2O(g)=NH4Cl(s);△H4=?kJ·mol-1
⑤NH3·H2O(g)+HCl(aq)=NH4Cl(aq)+H2O(l);△H5=-52.3kJ·mol-1
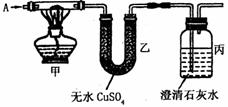 17.(12分)如下图所示,已知A是常见的纯净气体,甲中黑色粉末为氧化铜或炭粉或两者的混合物。
17.(12分)如下图所示,已知A是常见的纯净气体,甲中黑色粉末为氧化铜或炭粉或两者的混合物。
试回答下列问题:
(1)若A为CO2,在丙中导出可燃性气体,则甲中发生反应的反应方程式
(2)若甲中黑色粉末为氧化铜,实验过程中甲处黑色粉末变成红色,乙处无水CuSO4无变化,则通入的A为 ,丙中出现的现象为 ,丙中发生反应的离子方程式为
(3)若乙中无水CuSO4变成蓝色,丙中出现白色浑浊,则通入的A为 ,黑色粉末的成分是
18.(10分)下图中的每一个方格表示有关的一种反应物或生成物。已知X为一种盐,其分
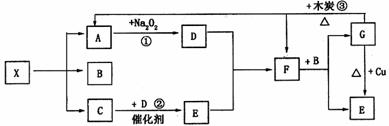 解产物中A、B、C的物质的量之比为1:1:1,A为无色无味气体。试完成下列问题:
解产物中A、B、C的物质的量之比为1:1:1,A为无色无味气体。试完成下列问题:
(1)写出下列物质的化学式
X ,F
(2)写出下列反应的化学方程式
反应① ,
反应② ,
反应③ 。
15.(12分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品a g,称取时使用的仪器名称为 。
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
(3)在滤液中加过量NaOH溶液,过滤。
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止。冷却后称量,质量为b g。有关反应的离子方程式为 ,该样品中铝的质量分数为
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果 (填“偏高”、“偏低”或“不影响”)。
②若步骤(4)中沉淀没有洗涤,则能使测定结果 (填“偏高”、“偏低”或“不影响”)。
14.(8分)用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来。
试完成下列问题:
(1)写出过氧化钠与水反应的化学方程式
 (2)由脱脂棉剧烈燃烧可以得出的结论是
(2)由脱脂棉剧烈燃烧可以得出的结论是
(3)某研究性学习小组,为进一步证明上述结论,拟用
如图所示的装置进行有关实验。请写出有关的实验
操作方法和现象
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com